一、中文标题
基于“设计-构建-测试-学习”框架重塑磷酸酶底物偏好性以调控生物合成(Reshaping Phosphatase Substrate Preference for Controlled Biosynthesis Using a “Design–Build–Test–Learn” Framework)
二、发表单位及通讯作者
· 发表单位:江南大学糖化学与生物技术教育部重点实验室、未来食品科学中心;山东润德生物科技有限公司
· 通讯作者:刘龙(Long Liu),邮箱:longliu@jiangnan.edu.cn
三、科学问题
如何通过理性设计改造磷酸酶BT4131的底物偏好性,使其优先催化N-乙酰氨基葡萄糖-6-磷酸(GlcNAc6P)而非葡萄糖-6-磷酸(Glc6P),从而提升GlcNAc在微生物细胞工厂中的合成效率?
链接:
https://advanced.onlinelibrary.wiley.com/doi/epdf/10.1002/advs.202309852

五、摘要
本研究提出一种结合量子力学(QM)的计算设计-构建-测试-学习(DBTL)框架,用于理性设计磷酸酶BT4131的底物偏好性。首先通过分子对接与动力学模拟筛选出关键突变位点L129Q(突变体M1),使其对GlcNAc6P的催化效率提升1.4倍。QM计算揭示该偏好性转变源于反应能垒降低13.59 kcal·mol⁻¹。进一步以稳定过渡态为目标进行迭代设计,获得三重突变体M4(I49Q/L129Q/C172L),其对GlcNAc6P的催化效率提升9.5倍,对Glc6P的催化效率降低59%。将M4导入GlcNAc生产菌株,结合GlcNAc6P响应型动态调控系统,在50-L发酵罐中GlcNAc产量达217.3 g·L⁻¹,转化率为0.597 g·g⁻¹葡萄糖,均为目前报道最高水平。该DBTL框架为工业生物催化剂的理性设计提供了高效范式。
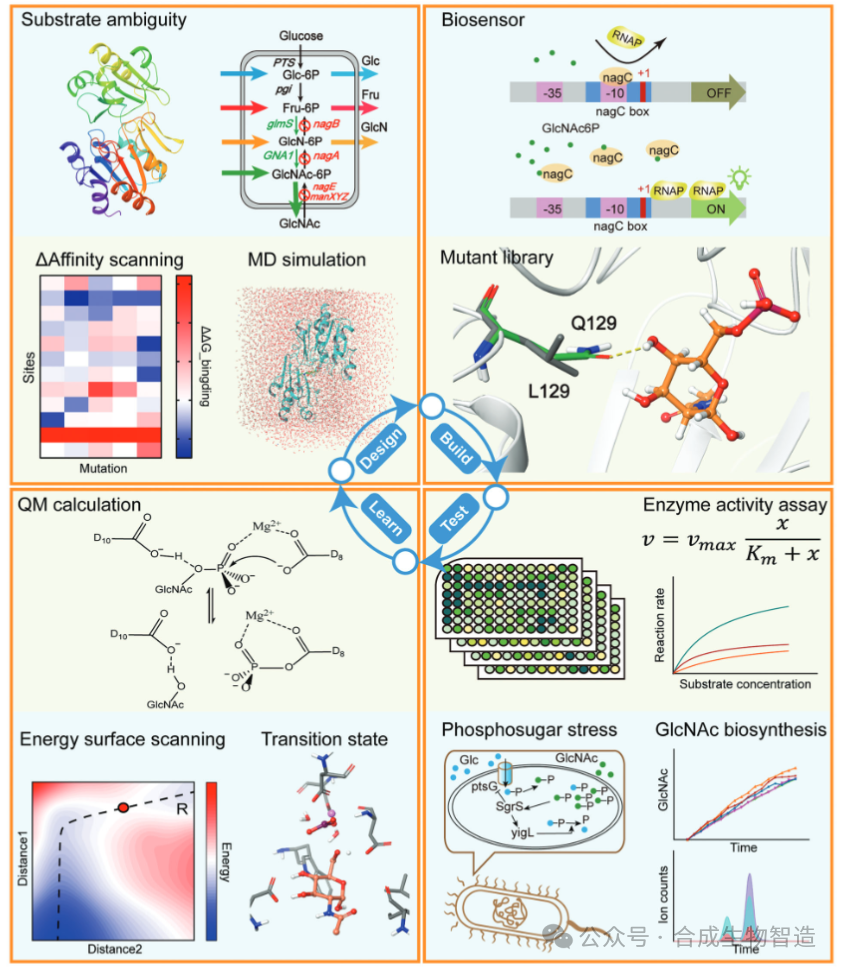
图1设计流程
六、研究背景
酶是微生物细胞工厂实现生物转化的核心元件。然而,天然酶往往催化性能有限,难以满足工业化生产对效率、选择性及稳定性的要求。传统的定向进化通过构建大规模突变库进行筛选,虽取得显著成果,但过程耗时费力且缺乏针对性。半理性设计基于蛋白结构信息缩小突变范围,提高了筛选效率,但对多点突变的组合效应预测仍不准确,难以实现精准的底物偏好性调控。
近年来,计算酶设计的兴起为理性改造酶提供了新途径。其中,量子力学计算能够从电子层面解析酶催化机制,揭示过渡态结构与能量变化,为设计高活性突变体提供理论指导。然而,如何将QM计算系统性地整合进蛋白质工程流程,形成可迭代的理性设计闭环,仍是领域内的重要挑战。
磷酸酶BT4131来源于Bacteroides thetaiotaomicron,在GlcNAc合成途径中负责催化GlcNAc6P去磷酸化生成GlcNAc。但其同时对Glc6P具有更高活性,导致碳流损失和副产物积累,严重影响GlcNAc合成效率。因此,精准改造BT4131的底物偏好性,使其“专一”催化GlcNAc6P,是构建高效GlcNAc细胞工厂的关键。
本研究旨在建立一种融合力场方法与QM计算的DBTL框架,通过理性设计精确调控BT4131的底物偏好性,提升GlcNAc生物合成效率,并为工业酶的理性设计提供可推广的方法论。
七、研究结果
结果1、基于力场方法的底物结合口袋初步设计与验证
对BT4131晶体结构分析发现其底物结合口袋主要由疏水残基构成。分子对接与动力学模拟表明,空间位阻并非影响底物选择性的关键因素,而口袋内极性分布可能起主导作用。通过虚拟突变扫描结合结合能变化(ΔAffinity)预测,发现L129Q突变能显著增强与GlcNAc6P的亲和力,同时减弱与Glc6P的结合。动力学模拟进一步显示,L129Q突变后Glc6P与关键催化残基D10的距离变得不稳定,而GlcNAc6P则能维持更稳定的反应构象。实验构建单点突变体M1(L129Q),而对Glc6P和果糖-6-磷酸(Fru6P)的催化效率分别降低63.5%和73.1%,初步实现了底物偏好性的定向转变。
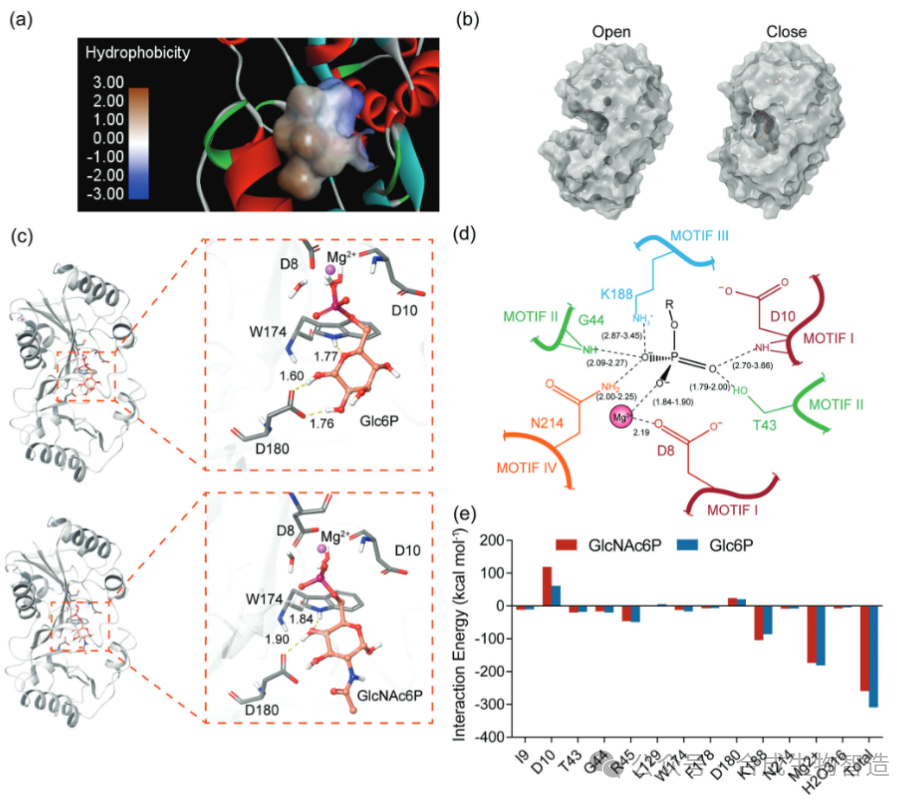
图2 分子对接结果
结果2、通过远程突变探索变构调控效应
为继续提升M1对GlcNAc6P的偏好性,对底物口袋上游残基进行第二轮虚拟扫描。发现位于第172位的半胱氨酸突变可进一步影响底物结合。实验构建双突变体M2(L129Q/C172L),其对GlcNAc6P的催化效率提升至WT的4.1倍,但意外的是对Glc6P的活性也同步升高,表明远距离突变可能通过变构效应影响催化中心,凸显了仅靠结合能预测设计多突变组合的复杂性。
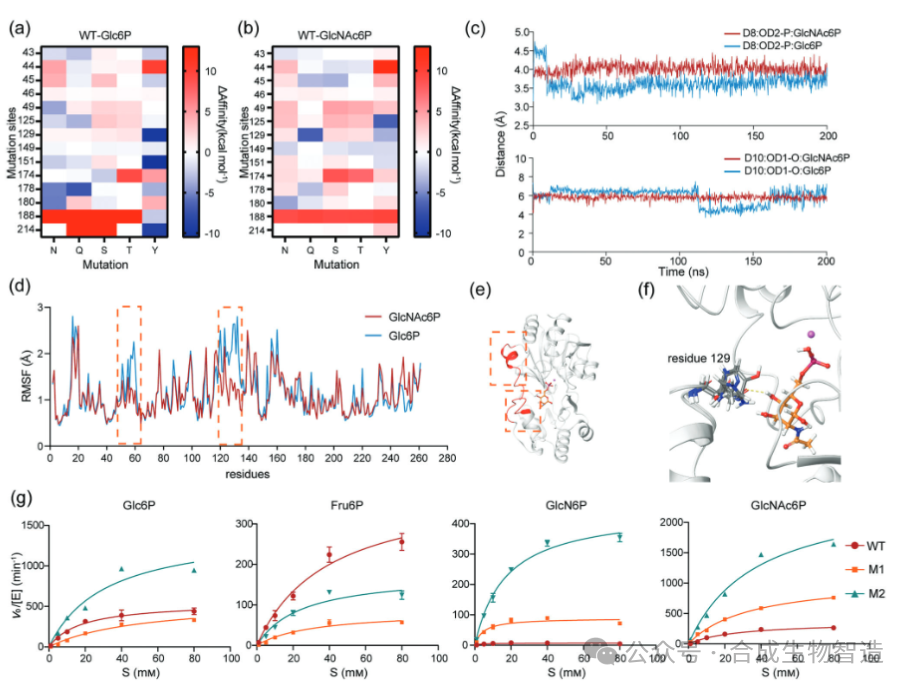
图3 MD模拟和虚拟突变
结果3、基于QM计算揭示底物偏好性转变的能垒机制
为深入理解催化效率变化的本质,对WT和M1与两种底物的复合物进行QM计算与势能面扫描。结果表明,M1与GlcNAc6P反应的过渡态能垒较WT降低了13.59 kcal·mol⁻¹,而与Glc6P反应的能垒则升高了8.04 kcal·mol⁻¹。这主要归因于:1)突变后GlcNAc6P在反应物构象中更靠近亲核试剂D8;2)在过渡态中,Q129与D180、W174形成“极性三角”氢键网络,稳定了GlcNAc6P的过渡态构象。相反,Glc6P在突变后难以形成稳定的反应构象,导致反应能垒升高。QM计算从能量层面揭示了底物偏好性转变的结构动力学根源。
结果4、聚焦过渡态稳定的迭代理性设计
基于QM揭示的机制,新一轮设计以稳定GlcNAc6P过渡态构象为核心目标。对靠近乙酰基的疏水残基I49进行虚拟突变扫描,预测其突变为谷氨酰胺(I49Q)能选择性稳定GlcNAc6P的过渡态。实验构建双突变体M3(I49Q/L129Q),其对GlcNAc6P的催化效率提升至WT的4.6倍,同时对Glc6P的活性被显著抑制。最终,结合前期有效突变,构建三重突变体M4(I49Q/L129Q/C172L),较WT提升9.5倍,而对Glc6P的催化效率降低59%,实现了底物偏好性的精准重塑。整个设计过程仅构建了不到10个突变体,极大提升了设计效率。
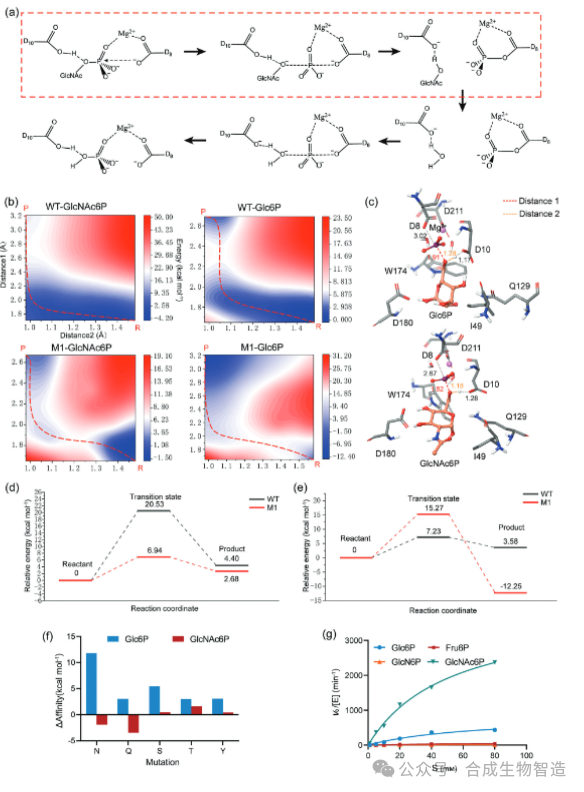
图4 机制解析
结果5、工程化磷酸酶在GlcNAc生物合成中的应用与验证
将优选突变体导入GlcNAc生产菌株,并配以基于转录因子nagC的GlcNAc6P响应型动态调控系统,实现磷酸酶表达的自我反馈调节。在50-L发酵罐中,表达M4的菌株GlcNAc产量达217.3 g·L⁻¹,转化率为0.597 g·g⁻¹葡萄糖,较对照菌株提升25.8%,且细胞生长迟滞现象缓解。动力学模型模拟进一步证实,磷酸酶对GlcNAc6P的高选择性是高效合成的关键。胞内代谢物检测显示,M4的引入显著降低了胞内GlcNAc6P积累,减轻了磷酸糖压力,从而提升了葡萄糖摄取和整体代谢通量。
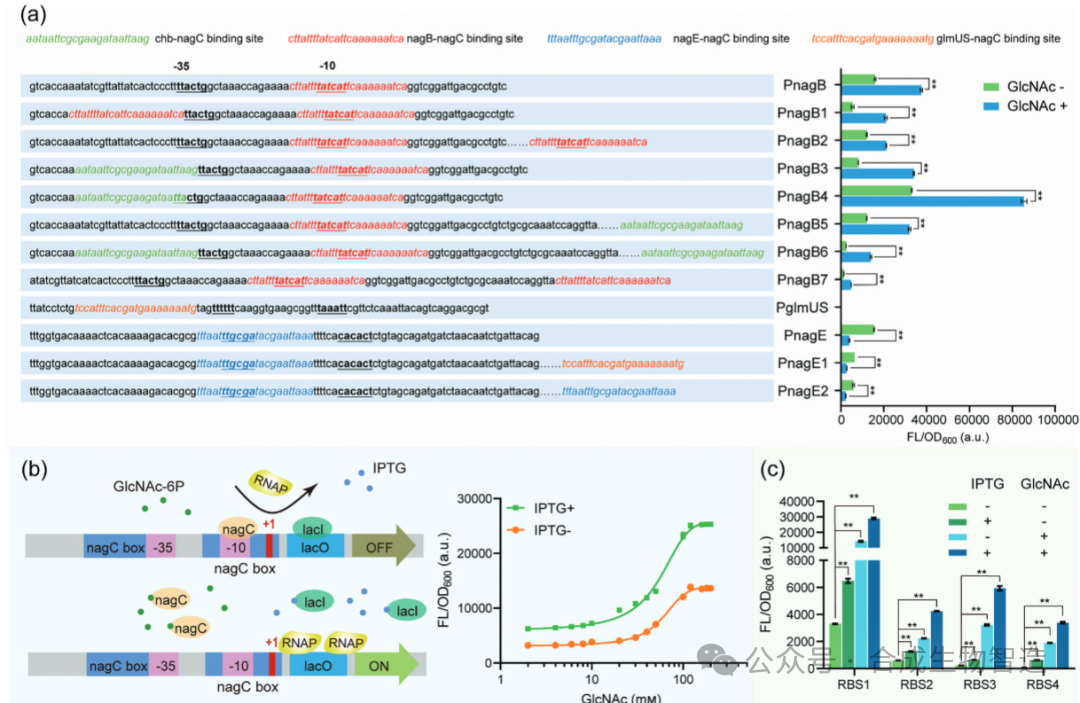
图5 动态调控系统应用
八、讨论
本研究成功构建了一个融合经典力场方法与量子力学计算的迭代DBTL框架,实现了对磷酸酶底物偏好性的精准、高效理性设计。该框架的先进性在于:1)通过QM计算直接从能量层面解析催化机制,指导以稳定过渡态为目标的迭代设计;2)将“学习”环节深度融入设计循环,使每次迭代都基于对前一轮结果的机理解析,显著提升了设计针对性和成功率;3)仅通过少量突变体测试即获得高性能催化剂,克服了传统方法依赖大规模库构建与筛选的瓶颈。该工作不仅为GlcNAc的高效生物制造提供了关键酶元件,也为工业酶的理性设计提供了一个可借鉴的强大范式,有望推广至其他需要精准调控底物特异性的生物催化过程。
