二岩藻糖基乳糖(DFL)作为人乳寡糖(HMOs)中的重要组分,具有显著的抗菌和免疫调节功能。然而,受限于关键酶α-1,3-岩藻糖基转移酶(α-1,3-FucT)的催化效率及发酵工艺,其工业化生产成本居高不下。近日,江南大学团队在 Journal of Agricultural and Food Chemistry 发表最新研究,通过挖掘来源于封丘芽孢杆菌(Bacillus fengqiuensis)的新型α-1,3-FucT,并结合半理性设计与高通量筛选,构建了高效工程菌株。在3-L补料分批发酵中,DFL产量达到65.12 g/L,为目前报道的最高水平。
在HMOs的生物合成中,糖基转移酶是核心“芯片”。传统的α-1,3-FucT多来源于幽门螺杆菌(H. pylori),存在表达量低、包涵体多、活性不理想等问题。如何获得具有工业级应用潜力的新型酶元件,是提升DFL产量的关键。
1. 从头合成路径的构建与模块优化 (Figure 1 & 2)
研究团队首先在 E. coli BL21(DE3) 底盘中构建了以甘油为碳源的DFL从头合成途径。路径设计(Fig. 1):引入GDP-L-岩藻糖合成途径(manC, manB, gmd, wcaG)以及双酶级联(α-1,2-FucT 和 α-1,3-FucT),将乳糖转化为DFL。
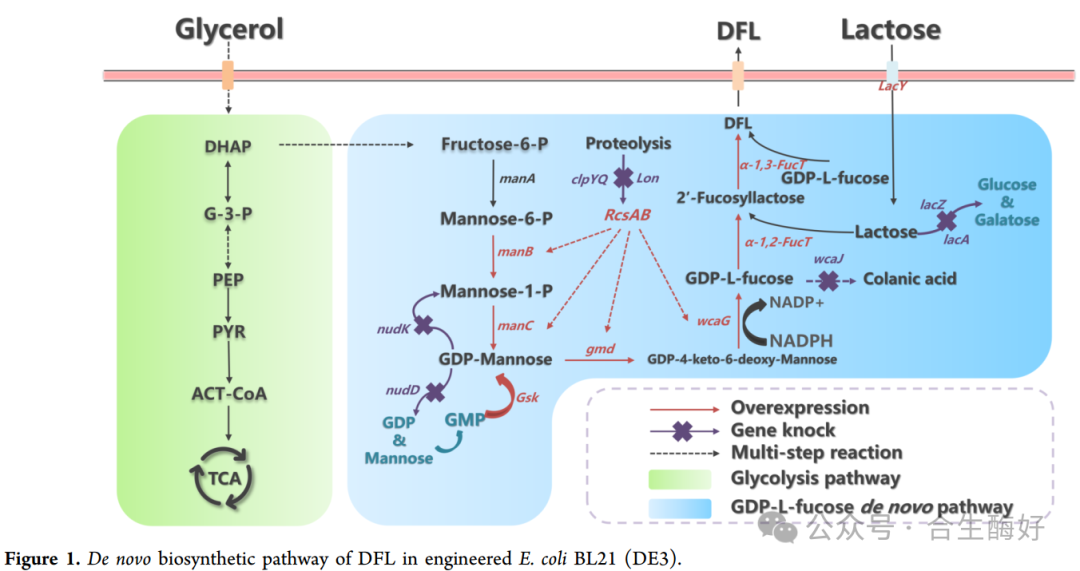
模块平衡(Fig. 2):为了解决多基因表达的代谢负担,作者通过组合不同拷贝数的质粒(pRSF, pCDF, pET),精细调节了代谢流。结果显示,BZ05菌株组合表现最佳,证明了基因表达水平的平衡对产物积累至关重要。

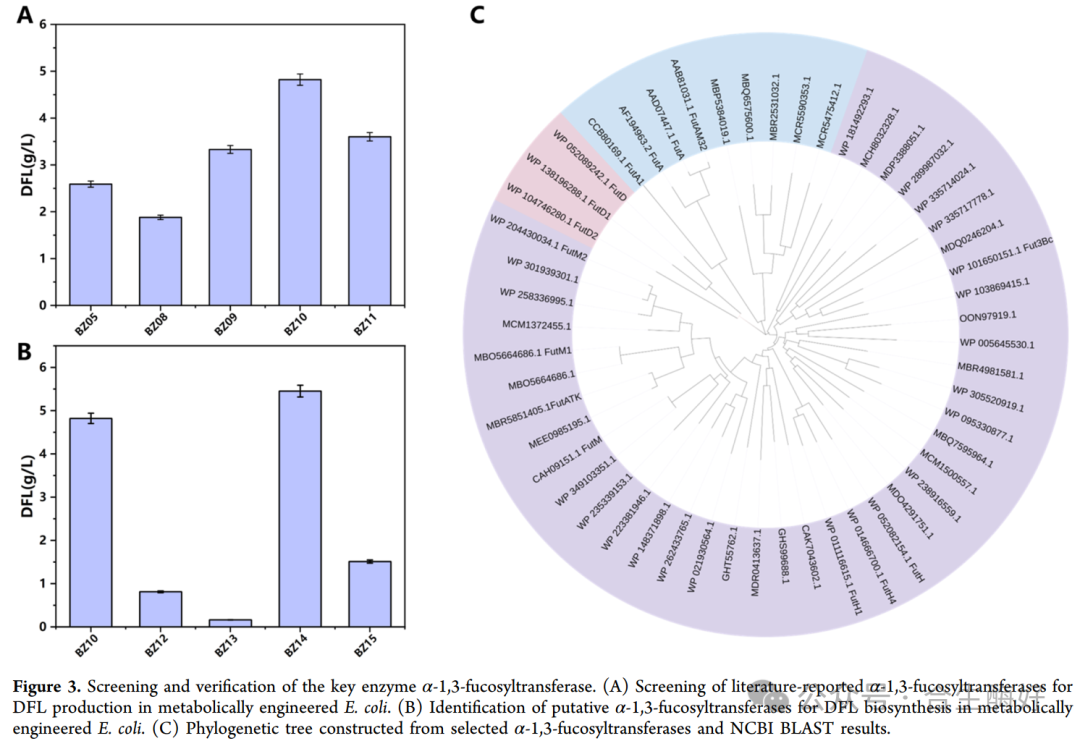
2. 新型酶元件的挖掘:锁定封丘芽孢杆菌 (Figure 3)
这是本研究的第一大亮点。系统发育分析(Fig. 3C):摒弃了常用的H. pylori 来源,团队基于序列同源性筛选了4个潜在的α-1,3-FucT。实测验证(Fig. 3B):来源于Bacillus fengqiuensis的 BfFucT表现出卓越的性能,相比于经典的Fut3Bc,其构建的菌株DFL产量更高。芽孢杆菌来源的酶通常具有更好的溶解性和稳定性,更适合工业发酵环境。
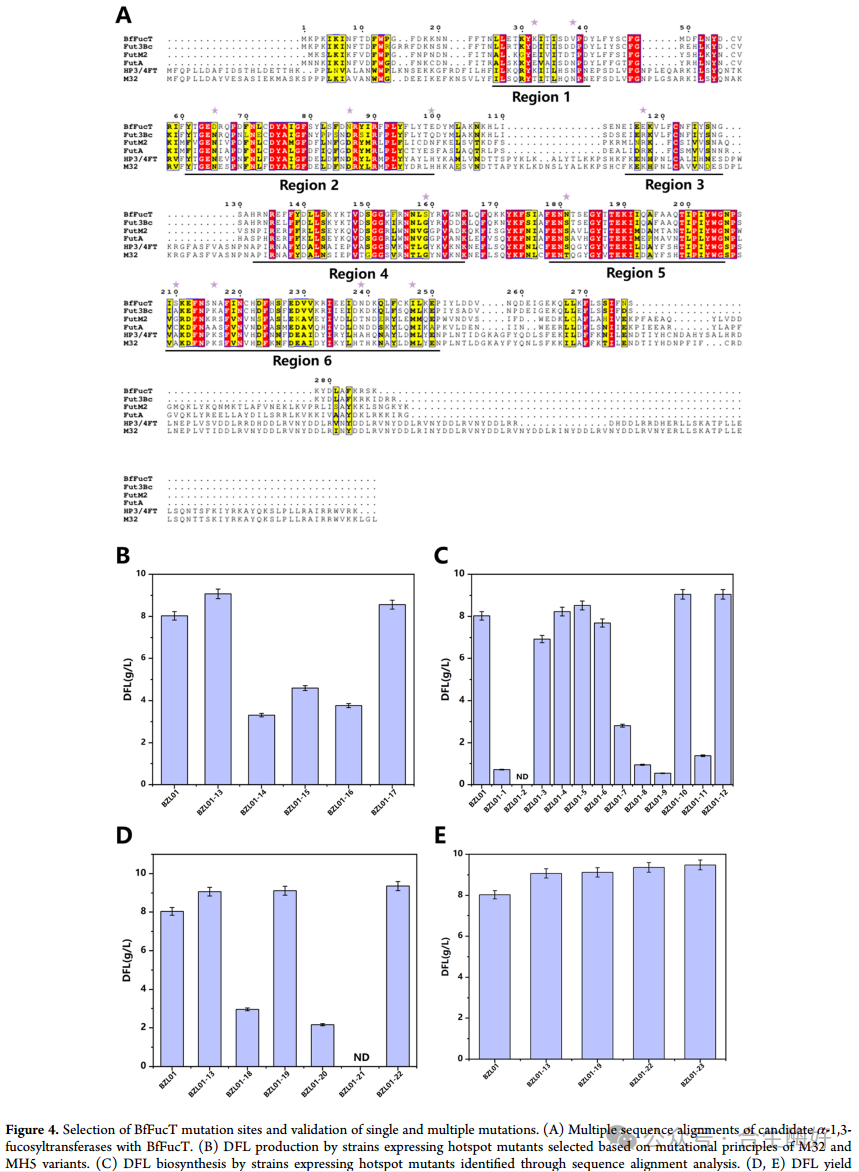
3. 半理性设计与“热点”突变 (Figure 4)
为了进一步提升BfFucT的催化效率,团队采用了“半理性设计”策略。策略一:序列比对(Fig. 4A):参考已知高活性的M32和MH5突变体,定位了5个关键位点。策略二:HotSpot Wizard 3预测:针对催化中心附近的残基进行饱和突变预测。结果(Fig. 4D/E):筛选得到单点突变体N25K和N276D显著提升了产量。随后,通过叠加有益突变,获得了五点组合突变体 MM5 (F22Y/N25K/T98K/E99Q/N276D),其DFL产量较野生型大幅提升。
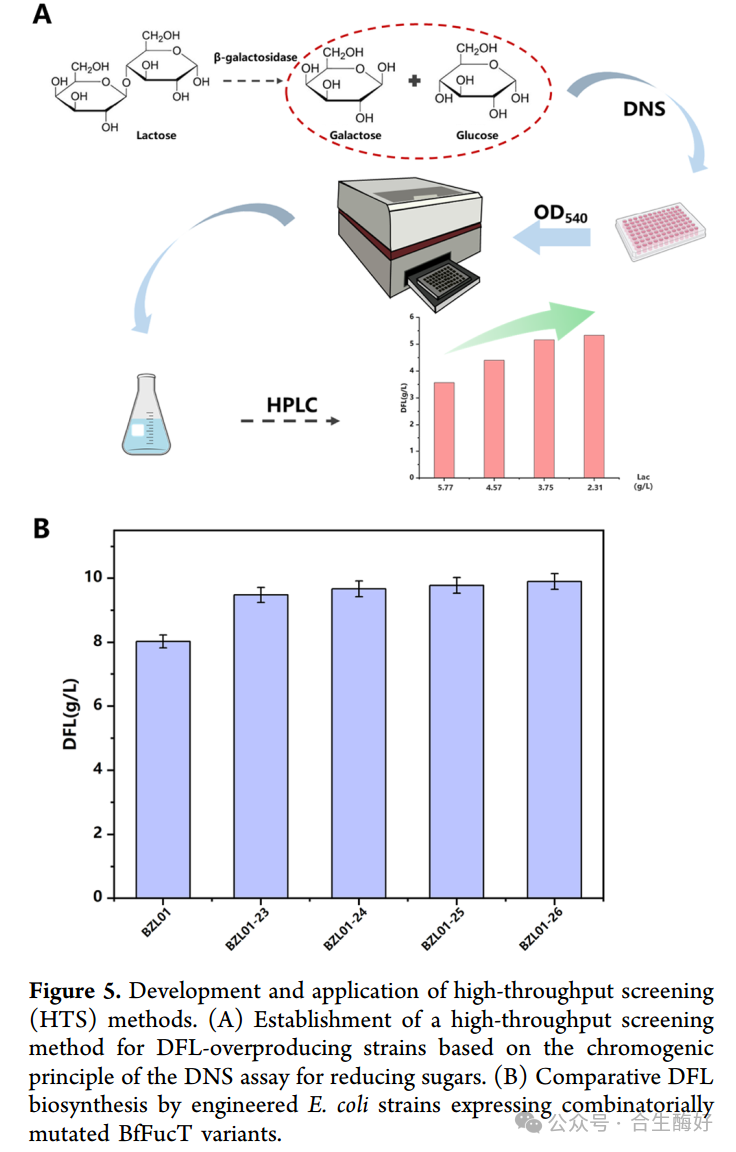
4. 突破筛选瓶颈:建立DNS高通量筛选平台 (Figure 5)
这是本研究的方法学创新。痛点:糖基转移酶反应不产生荧光信号,传统HPLC检测通量太低。原理(Fig. 5A):巧妙利用DNS法(3,5-二硝基水杨酸法)检测还原糖的变化。由于底物乳糖和产物DFL均为还原糖,但反应过程中涉及糖基供体的转移和副产物生成,通过优化反应体系,建立了吸光值与产物生成的关联。应用:这一HTS平台成功从数千个突变体中筛选出了高产菌株,极大地缩短了研发周期。
5. 分子动力学模拟揭示机制 (Figure 6)
RMSF分析(Fig.6B):突变体MM5在关键区域的均方根涨落(RMSF)显著低于野生型(WT)。这表明突变引入的氢键网络和静电相互作用(如F22Y引入的氢键,N25K/T98K引入的正电荷)增强了蛋白结构的刚性和稳定性。结构洞察:更稳定的结构有利于维持活性中心的构象,从而提高催化效率。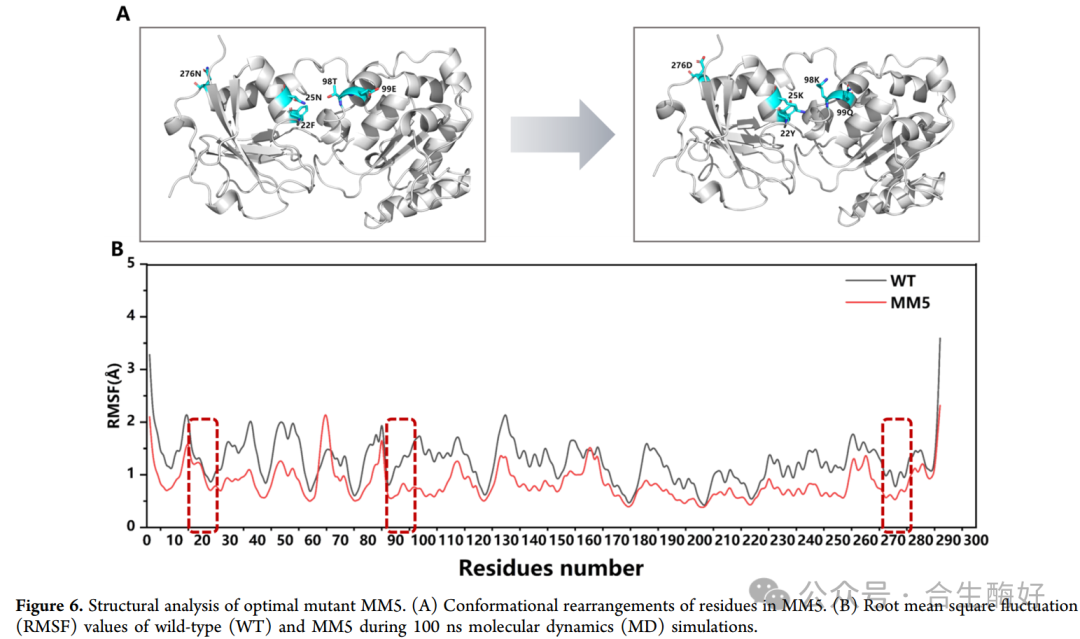
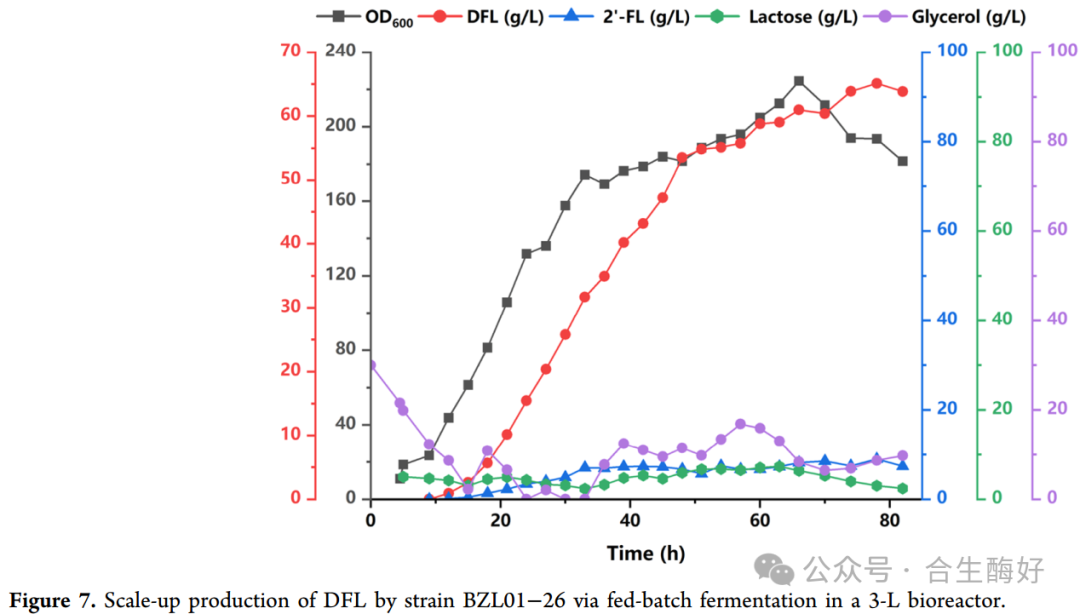
6. 工业化潜力验证:65.12 g/L 的里程碑 (Figure 7)
放大发酵:在3-L发酵罐中,使用MM5突变体的工程菌BZL01-26进行了补料分批发酵。数据:78小时发酵结束时,DFL滴度达到 65.12 g/L,生产强度为0.83 g/(L·h)。意义:这一数据刷新了目前公开报道的DFL发酵最高纪录,且底物甘油转化率良好,展示了极强的工业应用前景。