近日,重点实验室周楠迪教授团队成功构建出一种结合纳米荧光探针与微流控液滴技术的生物传感器,实现了全血中循环肿瘤细胞(CTCs)的高灵敏度检测。
周楠迪教授提到,CTCs携带着重要的肿瘤信息,在每毫升血液中,CTCs数量仅有1-10个,却混杂在数十亿正常血细胞中,对其进行检测好比“大海捞针”。研究团队研发的传感器基于CTCs胞内异常高表达的miRNA21作为检测标志物,克服了传统基于上皮细胞黏附分子(Epithelial cell adhesion molecule,EpCAM)检测方法的局限性,为癌症的液体活检、早期转移预警和个性化治疗监测提供了一种强有力的新型工具。
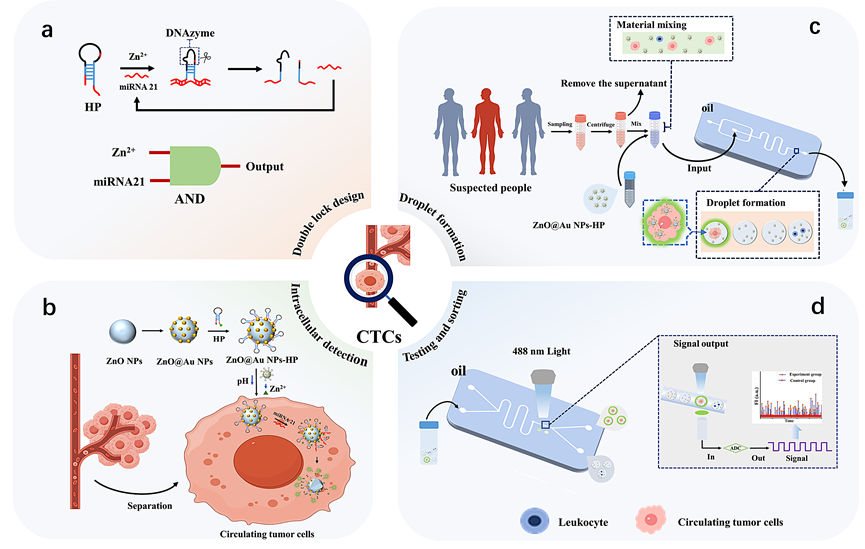
△ 图1 基于ZnO@Au NPs-HP纳米探针与单细胞液滴技术用于CTCs检测的原理图。(a) 基于“AND”逻辑门的探针设计;(b) ZnO@Au NPs-HP纳米探针对CTCs的胞内荧光检测;(c) 样品预处理与单细胞液滴制备;(d) 液滴的荧光检测与分选。
为评估所构建的集成纳米荧光探针与液滴技术传感器的检测性能,研究团队首先在血液样品中分别掺入三种不同种类的CTCs (HCT116、HepG2和HeLa)各5个进行加标检测。以HCT116细胞为例,传感器能够稳健地从复杂样品中检测出5个高荧光液滴(图2a),且其荧光强度值均显著高于预设的检测阈值(图2b)。在HepG2(图2c-d)与HeLa(图2e-f)细胞的检测中,均观察到一致的高效检出与荧光信号特征。上述结果表明,该传感器在多种CTCs模型的血样检测中均表现出优异的稳健性与可靠性。
进一步利用该平台对结直肠癌患者、肝癌患者、宫颈癌患者及健康个体的全血样本进行了检测。结果显示,传感器在健康对照样本中均未检出CTCs,而在测试的癌症类型样本中均成功检测到CTCs(图2g-h)。这一结果充分证明了传感器的高特异性,展现了其在癌症液体活检与病程监测方面的强大应用潜力。
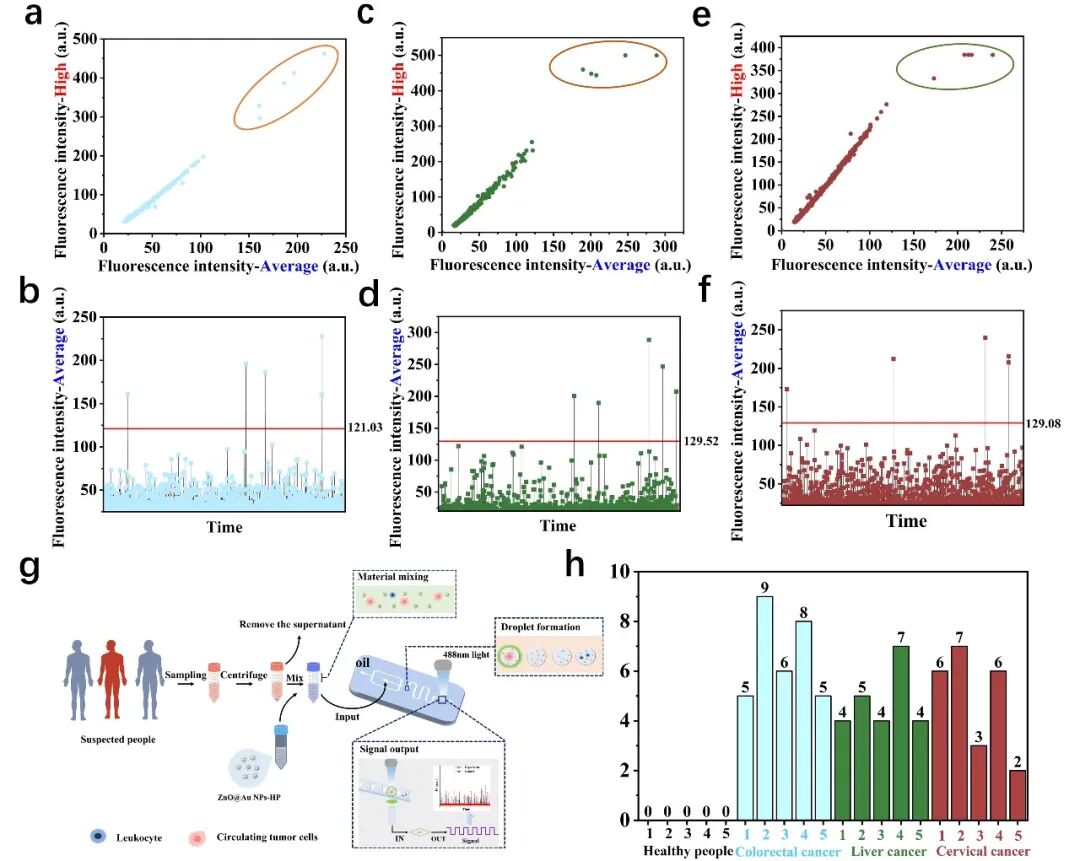
△ 图2 传感器的检测性能评估与临床样本验证。(a, c, e) 分别对应HCT116、HepG2及HeLa细胞液滴的荧光强度散点图;(b, d, f) 分别对应HCT116、HepG2及HeLa细胞液滴的平均荧光强度统计分析图;(g) 全血样本中CTCs检测流程示意图;(h) 传感器对健康个体与不同癌症患者全血样本的检测。
相关研究成果发表于国际权威期刊《生物传感器和生物电子学》(Biosensors and Bioelectronics)。论文第一作者是江南大学生物工程学院2023级博士蔡世欣,论文共同通讯作者是张雨婷副研究员和周楠迪教授。

近年来周楠迪教授团队在核酸适配体的筛选优化和应用、分子诊断技术、新型纳米生物传感器的研制、智能纳米器件的构建和应用、POCT产品研制、食品风味分析和安全检测、发酵过程中代谢物监测等方面取得丰硕成果,相关成果发表在Analytical Chemistry、Biosensors and Bioelectronics、Chemical Engineering Journal、Small、ACS Applied Materials & Interfaces、Sensors and Actuators B: Chemical、Journal Agricultural and Food Chemistry等本领域权威期刊。
