近期,江南大学生物工程学院糖化学与生物技术教育部重点实验室吴志猛教授团队在Chinese Journal of Chemistry杂志上发表了题为“Tumor Cell‐Specific Metabolic Labelling of Surface Sialoglycans and Post‐Click with Multivalent Rhamnose Enable Precise Immune Killing by Endogenous Antibody”的研究论文。该研究设计合成了一种β-葡萄糖醛酸酶(β-Glucuronidase,β-Glu)响应并带有叠氮基团的糖代谢前体Glu-AAM,并借助点击化学策略将多价鼠李糖(Rhamnose,Rha)选择性地共价锚定在高表达β-Glu的肿瘤细胞表面,从而实现募集高水平的抗Rha抗体用于肿瘤靶细胞的特异性杀伤。

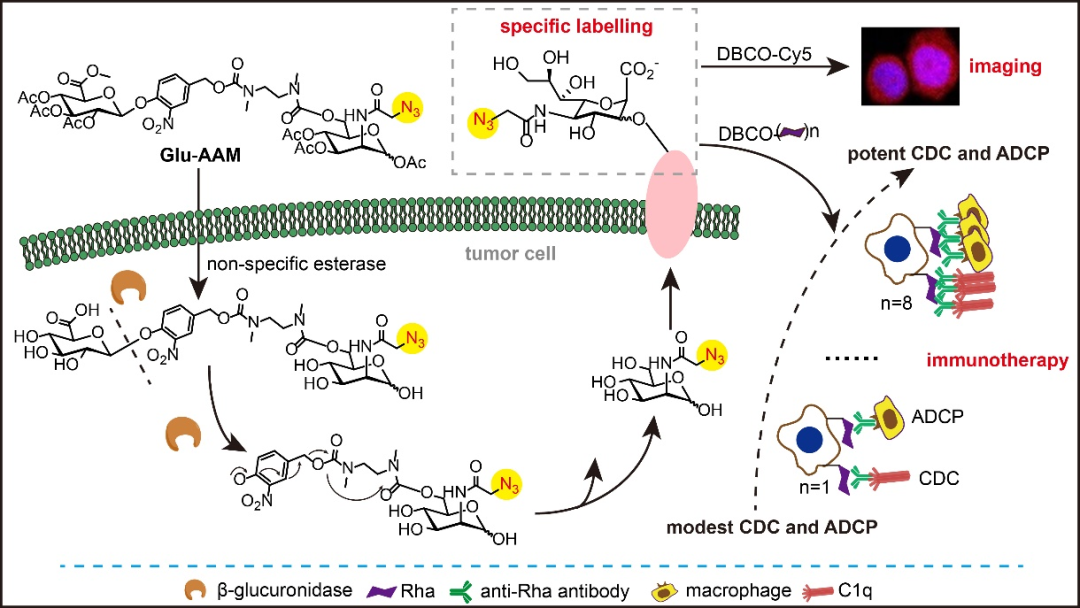
图1. 研究概览
研究背景
代谢糖工程(Metabolic glycoengineering, MGE)是一种细胞表面糖链修饰和标记技术,近年来被广泛应用于糖化学生物学研究和疾病的诊断和治疗[1]。该技术是以含有功能性官团(如叠氮,硫醇酮炔基)的非天然糖分子作为代谢前体,利用胞内各种专一性代谢途径和糖基化反应,实现对细胞表面天然糖链结构的功能化改造和修饰。其中,N-叠氮乙酰甘露糖胺(ManNAz)是研究最为广泛的代谢前体,它主要通过胞内唾液酸生物合成途径,以叠氮唾液酸代谢到细胞表面,具有毒性低、效率高等优势。然而,ManNAz的代谢标记过程可以同时发生在肿瘤细胞和正常细胞中,缺乏细胞选择性,因此开发具有肿瘤细胞选择性的代谢标记方法对于肿瘤靶向成像和靶向治疗具有重要意义。
近年来基于MGE的肿瘤细胞选择性唾液酸糖分子标记取得了显著进展[2]。例如,陈兴课题组利用配体修饰的脂质体装载非天然糖,用于细胞的选择性叠氮标记[3]。Shin课题组开发了一种H2O2依赖的代谢前体PBA-ManNAz(OAc)3,并成功用于肿瘤细胞的选择性标记和光动力治疗[4]。酶响应前药策略因其具有提高特异性和降低毒性的潜力,在癌症治疗中获得了显著关注[5]。一些在肿瘤细胞中过度表达的酶,如半胱氨酸蛋白酶、组蛋白去乙酰化酶和β-半乳糖苷酶等,也已被成功应用于肿瘤选择性代谢糖前体的设计和开发。Bertozzi课题组通过对Ac3ManNAz的C-6修饰,合成了对前列腺特异性抗原蛋白酶响应的代谢前体[6]。程建军课题组通过对Ac4ManNAz的异头碳修饰,合成了一种对组蛋白脱乙酰酶/组织蛋白酶L响应型的乙酰化叠氮甘露糖DCL-AAM,结果显示该前体在体外、体内均显示出良好的肿瘤选择性[7]。我们课题组在前期的一项研究中,开发了一种β-半乳糖苷酶依赖的代谢前体Gal-AAM,并成功将其用于肿瘤细胞的选择性表面聚糖成像和靶向免疫治疗[8]。
研究内容与结果
β-葡萄糖醛酸酶(β-Glucuronidase,β-Glu)属于酸性溶酶体酶,它在肝癌、乳腺癌、结肠癌、前列腺等多种恶性肿瘤中过度表达,是肿瘤治疗的理想靶标之一[9]。在这项工作中,我们以β-Glu为研究对象,首先设计并合成了带有叠氮基团的糖代谢前体Glu-AAM(图2),并以DBCO-Cy5为荧光探针,以NCM-460为β-Glu阴性细胞模型,以SKBR3、MCF7等为β-Glu阳性细胞模型,验证了Glu-AAM对β-Glu的响应性,及应用Glu-AAM实现肿瘤选择性成像的可行性(图3)。
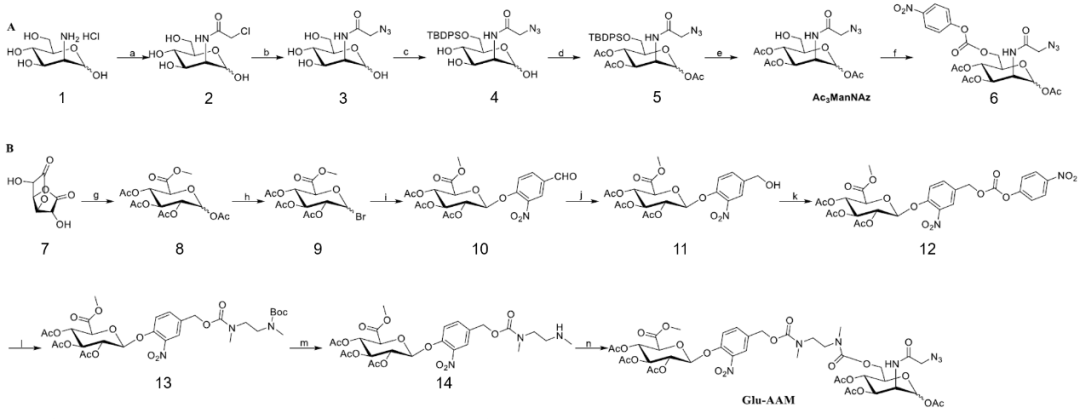
图2.糖代谢前体Glu-AAM的设计合成
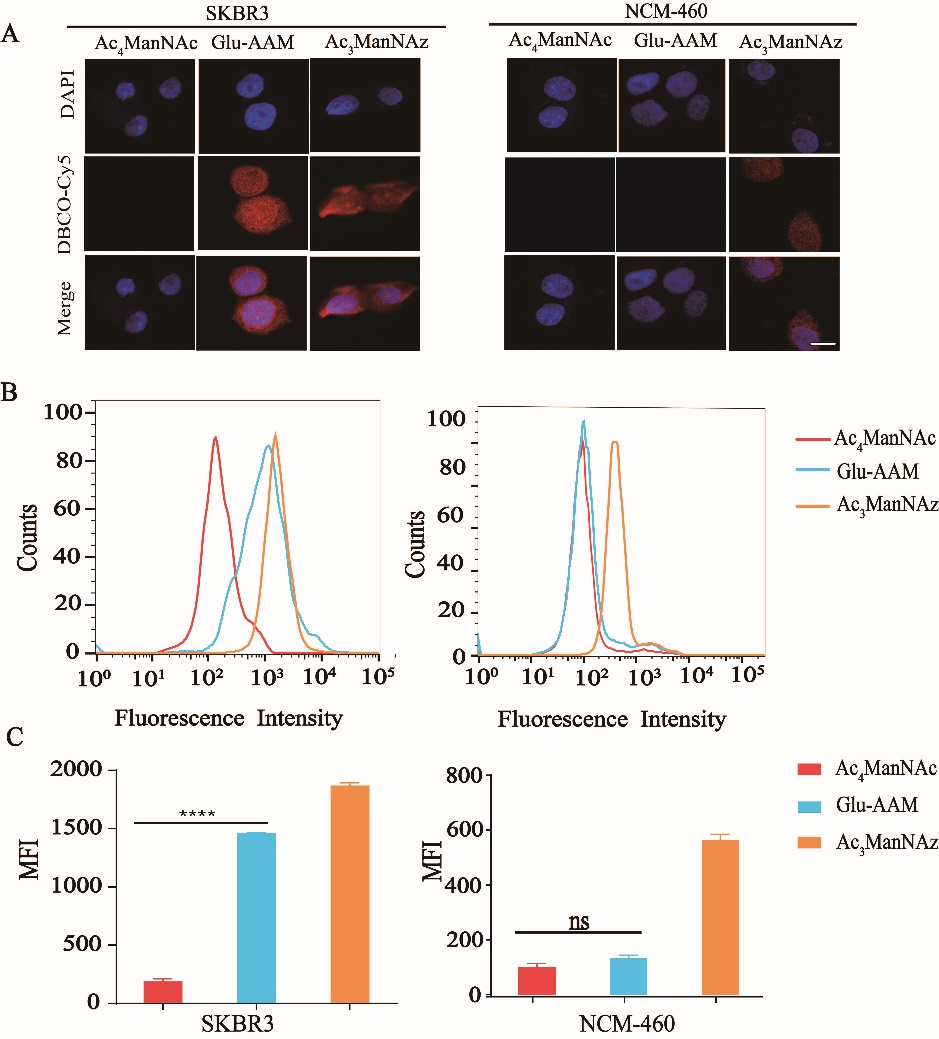
图3. Glu-AAM的选择性验证。(A)免疫荧光试验;(B)流式直方图及(C)其对应的平均荧光强度(MFI)图
接下来,我们对Glu-AAM在肿瘤免疫治疗中的应用潜力进行了评估。抗体募集策略旨在通过合理设计的双功能分子,将人体血清内天然存在或预免疫产生的内源性抗体募集至靶细胞表面,进而借助内源性抗体Fc端所介导的效应功能,如抗体依赖细胞介导的细胞毒作用(Antibody-dependent cell-mediated cytotoxicity, ADCC)、抗体依赖细胞介导的吞噬作用(Antibody-dependent cell-mediated phagocytosis, ADCP)和补体依赖细胞介导的细胞毒作用(Complement-dependent cytotoxicity, CDC),对靶细胞进行杀伤[10]。由于利用的是内源性抗体,该策略很大程度上避免了使用外源性抗体所带来的免疫原性副作用。在天然存在的内源性抗体中,抗Rha抗体又因其丰度较高、亲和能力好而备受关注。
基于此,我们首先化学合成含DBCO点击化学柄的单价及多价Rha衍生物:DBCO-Rha、DBCO-(Rha)2、DBCO-(Rha)4、DBCO-(Rha)8(图4A)。随后,为了评估四种Rha衍生物的抗Rha抗体募集能力,细胞相继用Glu-AAM(或Ac4ManNAc)、Rha衍生物、抗Rha血清、荧光标记二抗进行了处理。流式结果(图4B)显示,Glu-AAM预处理的SKBR3和MCF-7经Rha衍生物处理后,出现了明显的荧光偏移,而Ac4ManNAc处理组则未出现该现象,表明含DBCO的Rha衍生物可通过点击化学成功锚定在肿瘤靶细胞表面,并成功在原位招募抗Rha抗体;构效关系结果则显示,招募的抗Rha抗体与衍生物所包含的Rha分子数目呈正相关,八价Rha衍生物DBCO-(Rha)8具备最高的抗体募集水平。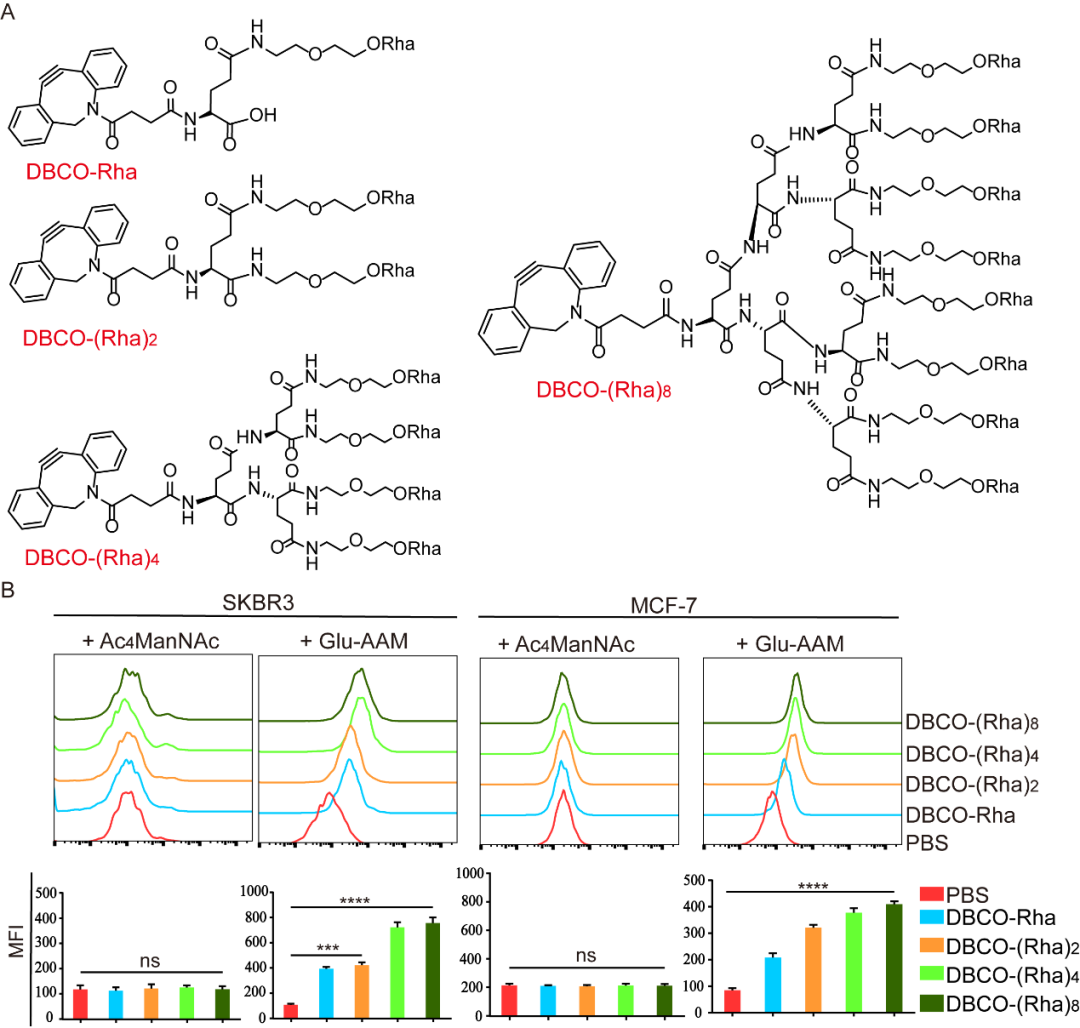
图4:(A)单价及多价Rha衍生物的分子设计;(B)Rha衍生物的抗体募集能力评估
最后,为探讨联合Glu-AAM与抗体募集策略对肿瘤细胞进行特异性杀伤的潜力,进行了CDC和ADCP实验。CDC研究结果(图5A-B)显示,Glu-AAM预处理的SKBR3和MCF-7细胞经Rha衍生物、抗Rha血清与乳兔补体处理后,出现了明显的细胞裂解现象,而对照组(Glu-AAM预处理的细胞经PBS、抗Rha血清与乳兔补体处理)则未观察到显著的细胞裂解,表明经Rha衍生物招募的抗Rha抗体,可成功激活补体系统对肿瘤靶细胞进行杀伤。在ADCP实验中,同样观察到了类似的现象(图5C-D),表明所招募的抗Rha抗体,也可成功激活效免疫细胞对靶细胞进行消除。此外,构效关系的结果与抗体募集结果相一致,招募能力最高的八价Rha衍生物DBCO-(Rha)8具备最强的介导CDC和ADCP作用的能力。
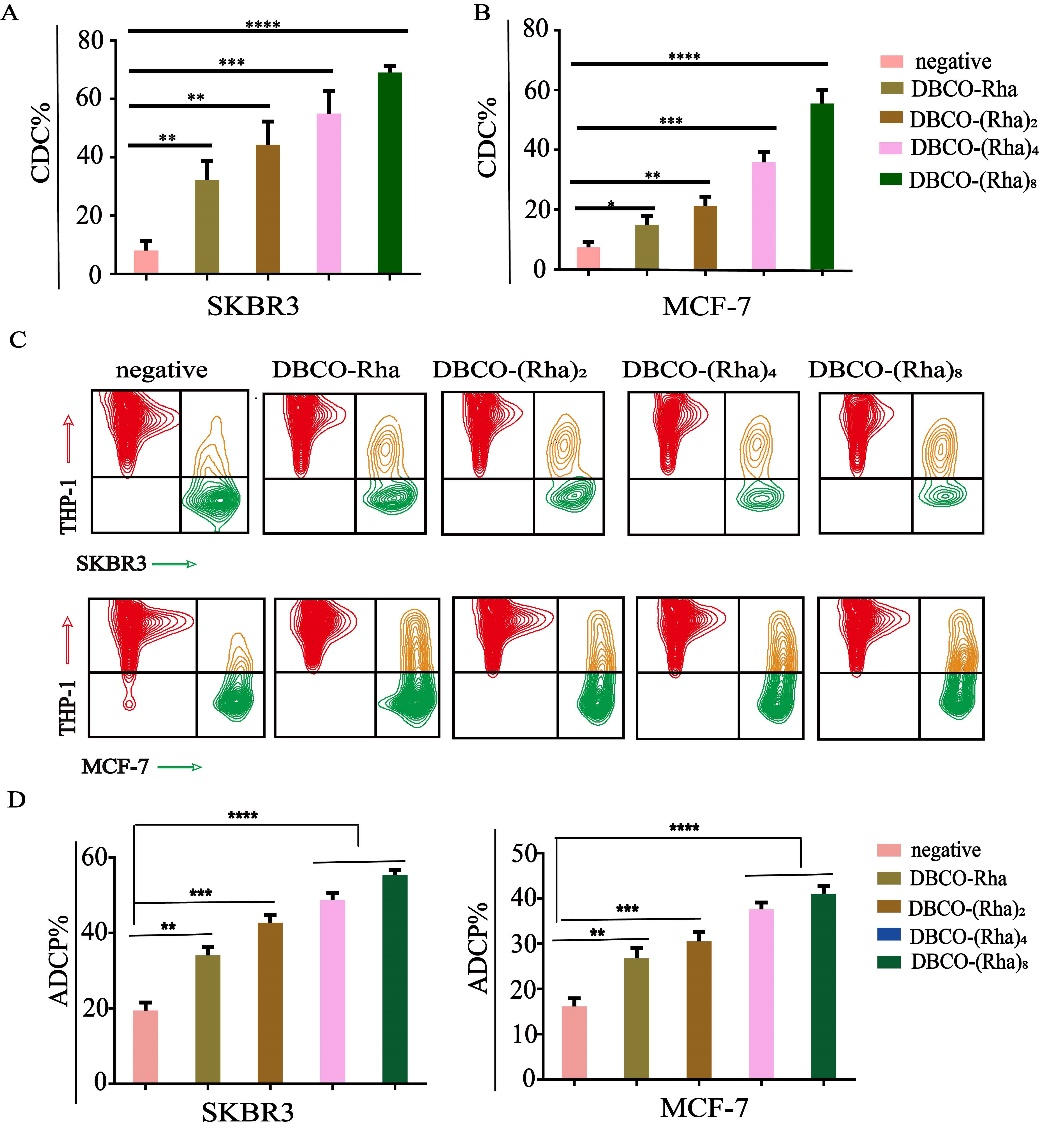
图5:Rha衍生物介导的CDC和ADCP活性评价。(A)对SKBR3的CDC作用;(B)对MCF-7的CDC作用;(C-D)对SKBR3和MCF-7的ADCP作用
[ 原文链接 ]
https://onlinelibrary.wiley.com/doi/10.1002/cjoc.202400855
[ 参考文献 ]
[1] Kufleitner M, Haiber L M, Wittmann V. Metabolic glycoengineering - exploring glycosylation with bioorthogonal chemistry [J]. Chemical Society Reviews, 2023, 52(2): 510-535.
[2] Cheng B, Tang Q, Zhang C, et al. Glycan labeling and analysis in cells and in vivo [J]. Annual Review of Analytical Chemistry, 2021, 14: 363-387.
[3] Xie R, Hong S L, Feng L S, et al. Cell-selective metabolic glycan labeling based on ligand-targeted liposomes [J]. Journal of the American Chemical Society, 2012, 134(24): 9914-9917.
[4] Park S H, Jung H, Lee H, et al. Cancer cell death using metabolic glycan labelling techniques [J]. Chemical Communications, 2020, 56(73): 10650-10653.
[5] Tu Y X, Gong J B, Mou J, et al. Strategies for the development of stimuli-responsive small molecule prodrugs for cancer treatment [J]. Frontiers in Pharmacology, 2024, 15: 1434137.
[6] Chang P V, Dube D H, Sletten E M, et al. A strategy for the selective imaging of glycans using caged metabolic precursors [J]. Journal of the American Chemical Society, 2010, 132(28): 9516-9518.
[7] Wang H, Wang R, Cai K, et al. Selective in vivo metabolic cell-labeling-mediated cancer targeting [J]. Nature Chemical Biology, 2017, 13(4): 415-424.
[8] Li Y, Gong L, Hong H, et al. beta-Galactosidase-dependent metabolic glycoengineering of tumor cells for imaging and immunotherapy [J]. Chemical Communications, 2022, 58(15): 2568-2571.
[9] Martin H, Lázaro L R, Gunnlaugsson T, et al. Glycosidase activated prodrugs for targeted cancer therapy [J]. Chemical Society Reviews, 2022, 51(23): 9694-9716.
[10] Charles W Z, Faries C R, Street Y T, et al. Antibody-recruitment as a therapeutic strategy: A brief history and recent advances [J]. ChemBioChem, 2022, 23(16): e202200092.
