人乳寡糖生物合成制备与应用进展

研究论文:2025年11月,江南大学张洪涛团队在《Glycoscience & Therapy》
在线发表题为“Advances in biosynthetic preparation and application of human milk oligosaccharides”的文章。
原文出处:《Glycoscience & Therapy》
原文链接:https://doi.org/10.1016/j.glycos.2025.100012
第一作者:赖霞
通讯作者:张洪涛(htzhang@jiangnan.edu.cn)
通讯单位:江南大学生物工程学院糖化学与生物技术教育部重点实验室
导语
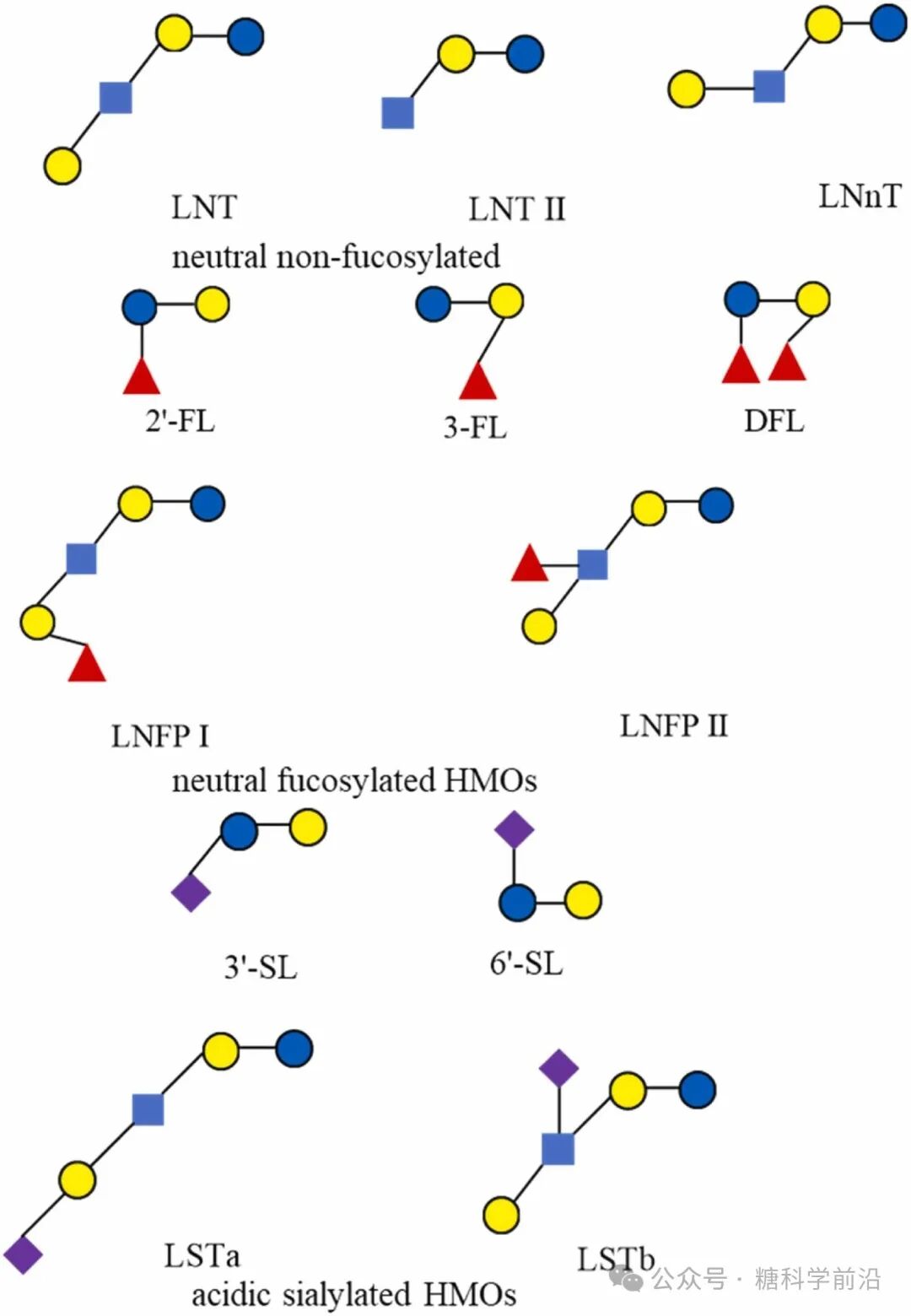
母乳寡糖(HMOs)是存在于母乳中的生物活性分子,在塑造婴儿肠道微生物群、增强婴儿免疫力及抵抗各种病原体感染的能力中发挥着重要作用。随着HMOs在婴幼儿营养健康领域的不断发展,其作为功能性成分已被应用于婴幼儿配方奶粉及其他食品中。HMO的生物合成制备、工业规模生产及商业应用日益受到公众的广泛关注。本文重点关注2’-FL, 3-FL, DFL, LNT, LNnT, LNT II, 3’-SL, and 6’-SL的合成及其应用,强调了各种合成策略和该领域的最新进展。文章指出了HMO合成中的挑战,对未来合成HMOs提供方向。此外,该综述还旨在为优化大规模生产提供一些见解,以支持HMO未来在食品和制药领域的应用。
文解读
研究亮点与创新点:
1.系统性的代谢工程与酶工程策略显著提升了HMOs的合成效率
本综述系统阐释了通过代谢工程与酶工程的协同策略,实现HMOs高效生物合成的突破。在代谢工程层面,研究聚焦于重构底盘细胞(主要为大肠杆菌)的核心代谢网络,通过敲除竞争途径基因(如lacZ, wcaJ)并强化GDP-L-岩藻糖、UDP-半乳糖等关键前体的供应模块,从而将碳流高效导向目标产物合成途径。在酶工程层面,针对岩藻糖基转移酶、β-1,4-半乳糖基转移酶等限速酶,采用基于结构的理性设计与定向进化策略,有效解决了其催化活性不足、底物特异性差和可溶性表达水平低等瓶颈问题。这种对“细胞工厂”系统与“催化元件”功能的双重优化,使得代表性产物2’-FL的发酵水平达到121.4 g/L,LNnT达到112.47 g/L,标志着其生物制造已具备工业化生产的成本可行性。
2.明确了下游分离纯化是制约HMOs产业化的关键瓶颈并指明技术方向
本文的一个关键贡献在于,它清晰指出当前HMOs规模化生产的核心挑战已从上游的合成生物学构建,转移至下游的高纯度分离与精制。由于HMOs结构中存在大量异构体(如:LNT、LNnT等),且发酵液中混杂宿主蛋白、核酸、内毒素等复杂杂质,传统实验室色谱方法在收率、成本及通量上均无法满足工业级需求。对此,文章前瞻性地提出了面向大规模生产的分离纯化解决方案,重点评估了连续色谱技术、模拟移动床色谱及与膜过滤工艺集成的潜力。这一分析将分离科学与工程学的重要性提升至与合成生物学并重的战略高度,为从“发酵液”到“高纯度产品”的转化提供了清晰且必需的技术发展路径。
3.HMOs的功能研究揭示了其超越婴幼儿营养的广阔应用前景
本综述突破性地总结了HMOs在婴幼儿营养之外,于全生命周期健康领域的应用科学依据。文章基于其调节肠道菌群、增强上皮屏障、抑制病原体粘附及免疫调节等分子机制,系统论证了其在成人健康市场及特医食品领域的潜力,例如:2’-FL与LNnT在维持肠道微生态平衡与免疫稳态中的作用,为其进入功能性食品提供了支撑。更为重要的是,特定结构HMOs(如二唾液酸乳糖-N-四糖,DSLNT)在临床前模型中显示出对坏死性小肠结肠炎(NEC)的显著预防效果,揭示了其在疾病预防与医疗营养中的独特价值。这标志着HMOs正从传统的母乳寡糖模拟物,转变为具有明确健康功能的生物活性分子,为其产业应用开辟了全新的赛道。
主要研究内容:
1. 中性岩藻糖基化HMOs的高效合成路径
岩藻糖基化HMOs凭借其核心丰度与免疫调节功能,成为产业化优先级最高的品类。其合成效率取决于GDP-L-岩藻糖前体的供应与岩藻糖基转移酶的特异性。
2’-FL的合成已构建成熟的“从头合成”细胞工厂。以大肠杆菌工程菌为例,通过敲除竞争途径基因(如lacZ, wcaJ),并模块化过表达关键酶基因(manB, manC, gmd, wcaG),将碳流导向GDP-L-岩藻糖的合成。例如,在C43(DE3)工程菌中以甘油为碳源,发酵64小时产量达121.4 g/L,生产强度为1.90 g/L/h,展示了工业化生产的巨大潜力。
3-FL与DFL的合成则依赖特异性酶工程与途径平衡。3-FL的合成关键在α-1,3-岩藻糖基转移酶(如源自幽门螺杆菌的酶),通过理性设计提升其对乳糖的催化效率,在BL21 Star(DE3)菌株中产量达60.24 g/L。而DFL的合成则需协调α-1,2与α-1,3两种岩藻糖基转移酶的活性,通过质粒组合调控与代谢流再分配,在5L发酵罐中实现了55.3 g/L的高产。
图1. 2’-FL的生物合成途径。
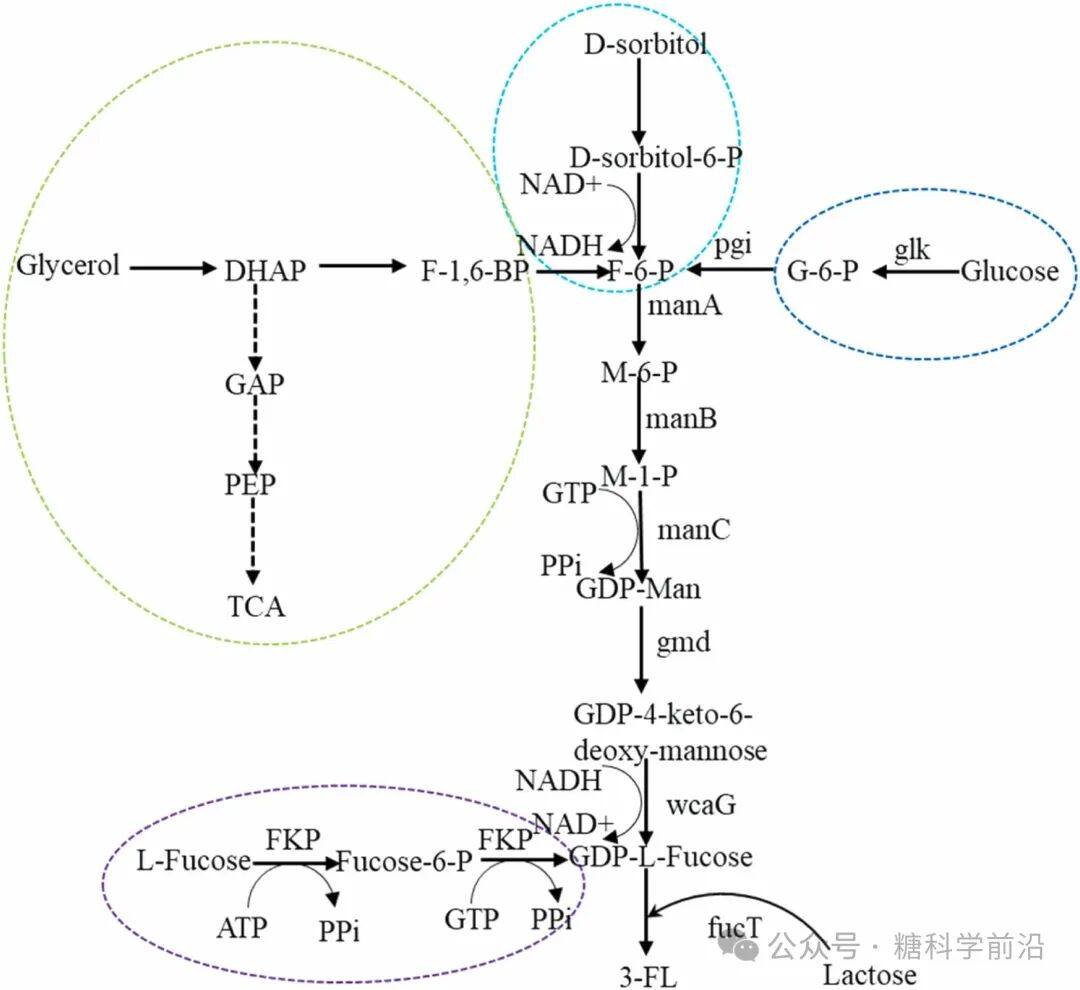
图2. 3-FL的生物合成途径。
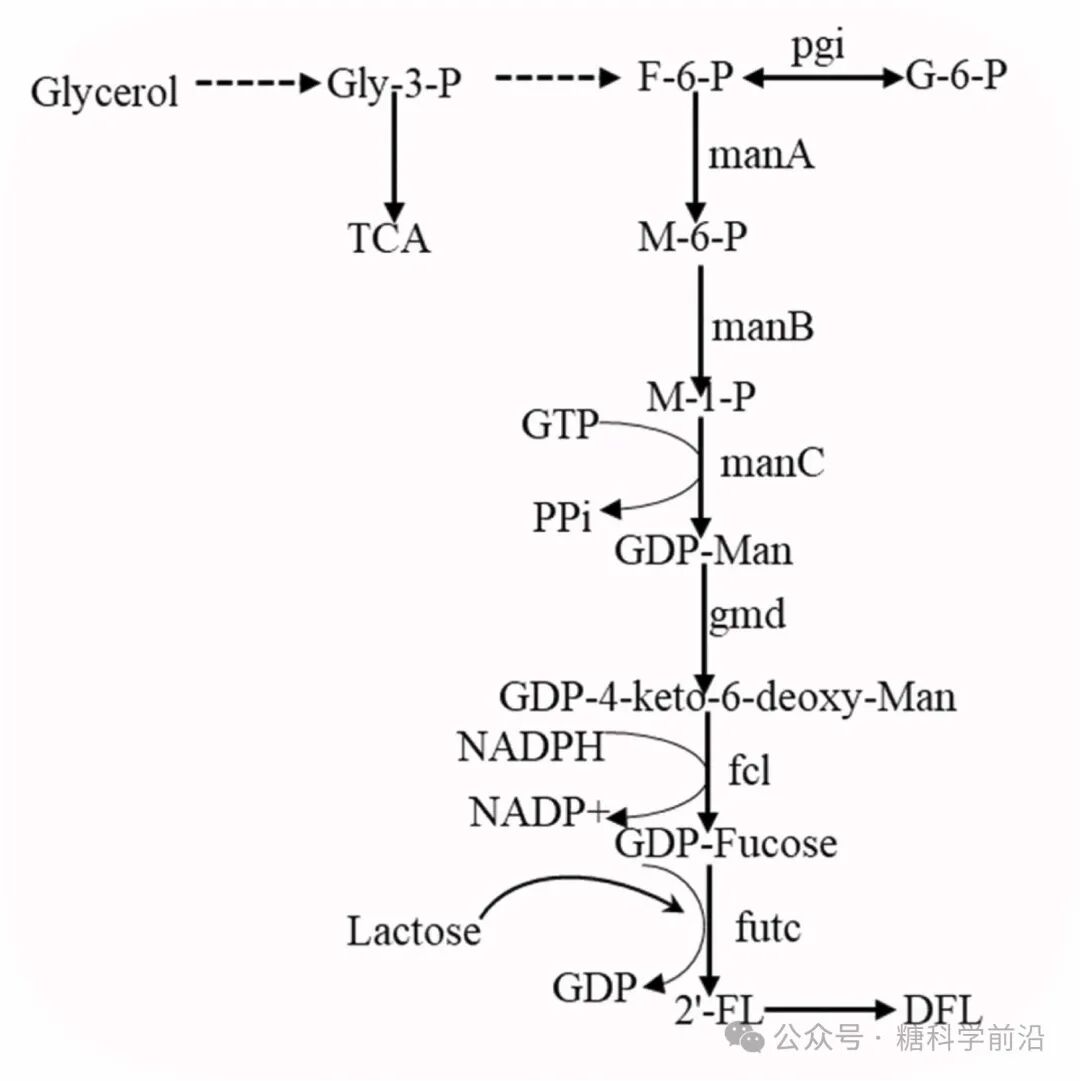
图3. DFL的生物合成途径。
2. 中性非岩藻糖基化HMOs:LNT与LNnT的构建
以LNT(乳糖-N-四糖)和LNnT(乳糖-N-新四糖)为代表的非岩藻糖基化HMOs,其合成挑战在于精确构建β-1,3与β-1,4糖苷键以及平衡UDP-半乳糖与UDP-GlcNAc两大前体库。
LNT II与LNT的合成依赖于β-1,3-N-乙酰葡糖胺转移酶(LgtA)的高效表达。通过增强宿主内源性UDP-GlcNAc合成途径,并以廉价甘油替代昂贵的GlcNAc作为原料,可将LNT II产量提升至57.44 g/L。LNT的合成则进一步需要β-1,3-半乳糖基转移酶(如WbgO),通过共表达半乳糖代谢基因(galE, galT, galK)强化UDP-半乳糖供应,使LNT产量达到57.5 g/L。
LNnT的高产记录体现了系统代谢工程的威力。通过将来自不同微生物的高效β-1,4-半乳糖基转移酶基因整合至大肠杆菌染色体,并采用葡萄糖/甘油混合碳源饲喂策略,在5L规模下实现了112.47 g/L的惊人产量,为目前所有HMOs中的最高纪录。
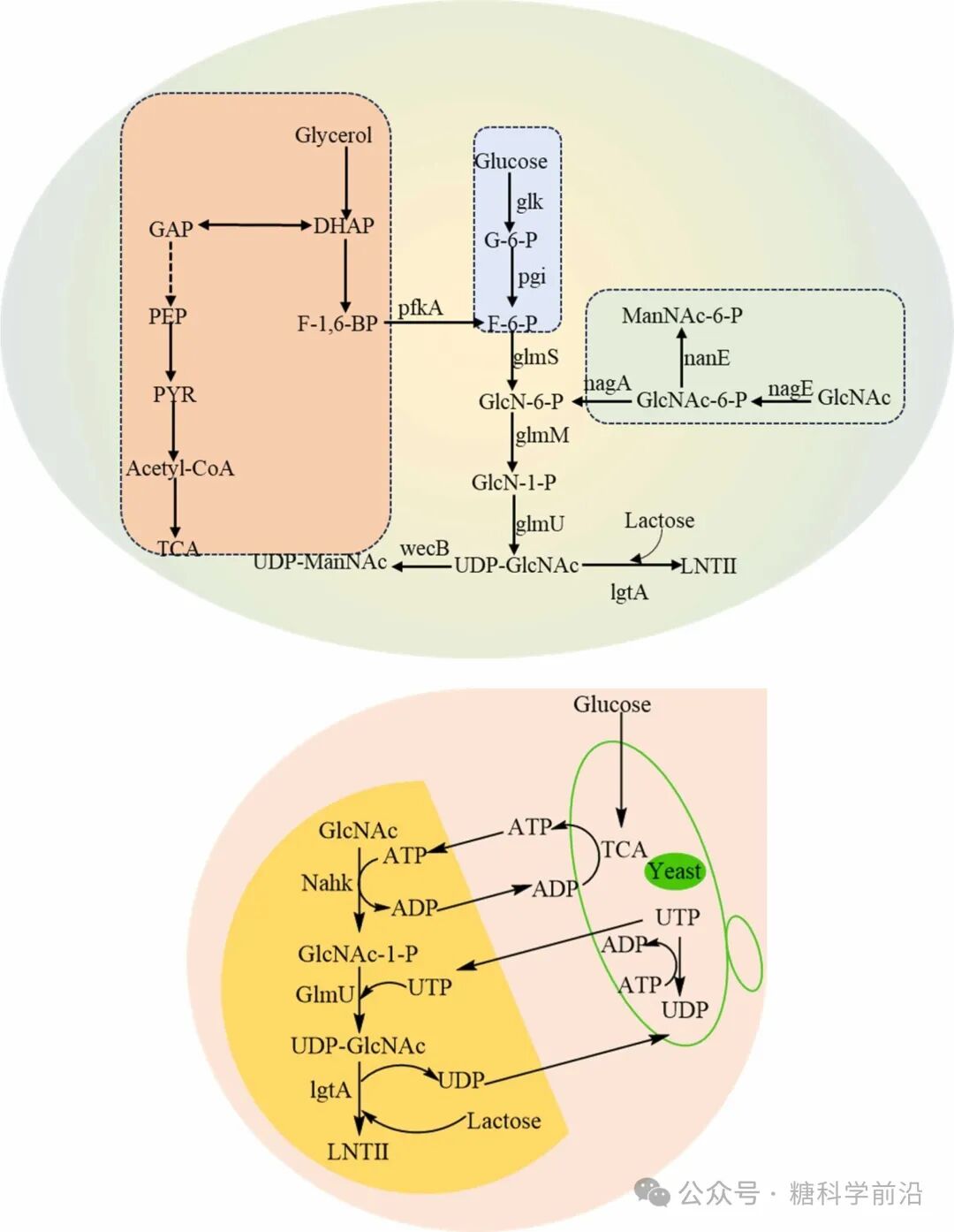
图4. LNT II的生物合成途径。
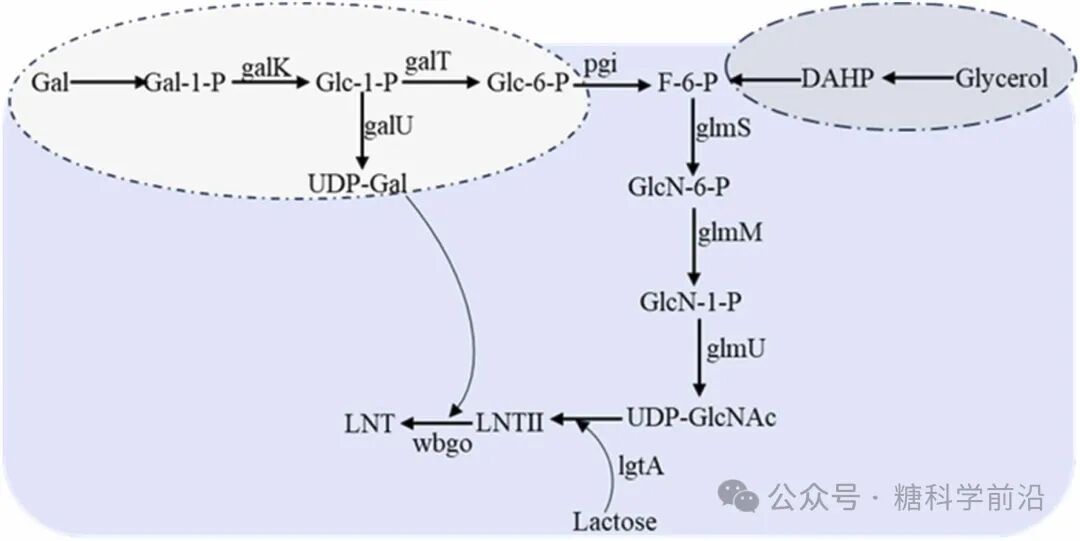
图5. LNT的生物合成途径。
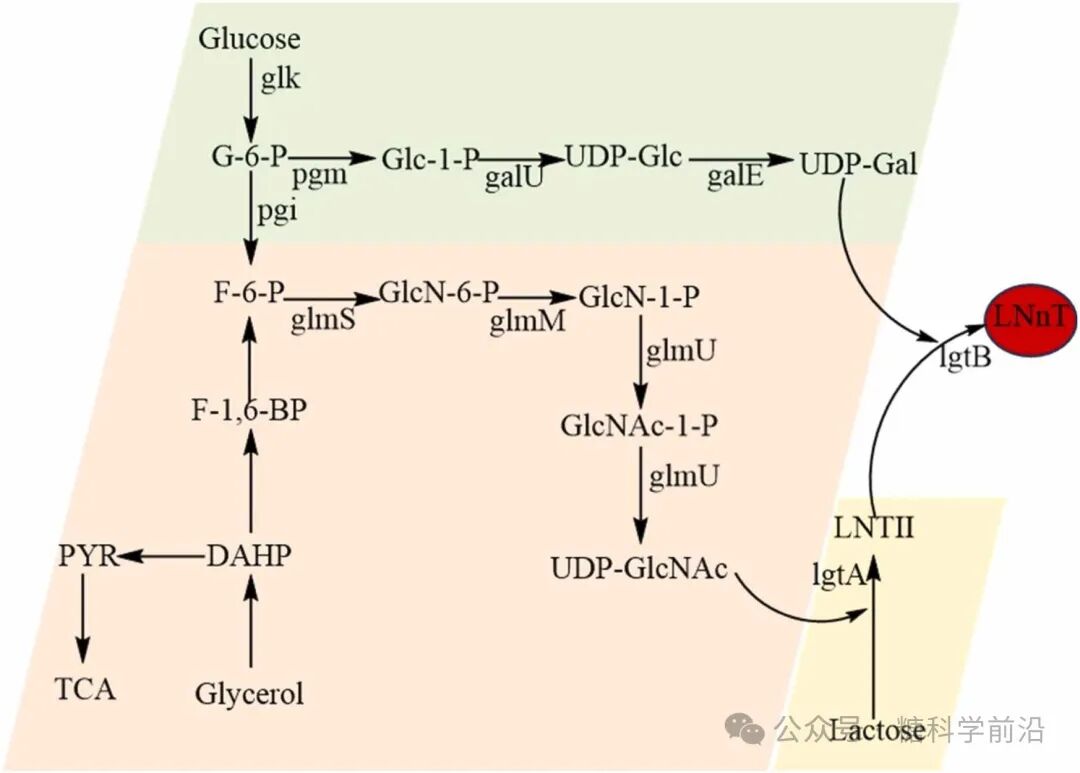
图6. LNnT的生物合成途径。
3. 唾液酸化HMOs:3’-SL与6’-SL的酶法构建
唾液酸乳糖(SL)的合成核心在于构建α-2,3或α-2,6糖苷键,并解决CMP-唾液酸这一高成本活化供体的供应问题。
微生物细胞工厂法是主流方向。通过在大肠杆菌中构建从GlcNAc到CMP-Neu5Ac的完整合成途径,并引入高效的α-2,3或α-2,6-唾液酸转移酶,可实现SL的从头合成。例如,通过模块化工程和动态调控,3’-SL的产量已达56.8 g/L。多菌耦合催化则提供了另一种思路,将不同菌株分工负责前体合成、辅酶再生和最终糖基化,从而减轻单菌代谢负担,提升了体系稳定性与产物浓度。
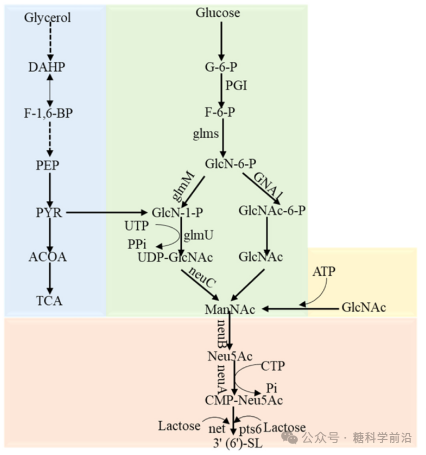
图7. 3’(6’)-SL的生物合成途径。
4. HMO的应用
HMOs构建了“基础营养—功能食品—医疗干预”的梯次化应用生态,其价值正从婴幼儿领域向全生命周期健康管理扩展。主要包括以下方面:
(1) 婴幼儿配方奶粉的核心高端配料
HMOs的添加是婴配粉实现“母乳化”的关键一步。目前,2’-FL和LNnT已在全球主要市场获得法规批准并广泛应用。多个知名品牌已推出含有2’-FL、LNT、LNnT、DFL等多种HMOs组合的配方产品,旨在更全面地模拟母乳的免疫功能。
(2)成人功能性食品与饮料的新兴成分
随着对肠道微生态研究的深入,HMOs作为优质益生元,正被添加至酸奶、功能性饮料、营养补充剂等产品中,用于调节肠道菌群、支持免疫健康。其稳定性和良好的口感特性,使其在食品工业中应用前景广阔。
(3)潜在的医疗营养与治疗应用
部分HMOs展现出明确的生物活性,具有向特医食品和药物辅料发展的潜力。包括:①预防特定疾病:如DSLNT(二唾液酸乳糖-N-四糖)在临床前研究中显示出预防早产儿坏死性小肠结肠炎(NEC)的显著效果;②调节免疫与抗炎:LNnT和LNT被证实具有抗炎特性,或可用于缓解炎症性肠病、过敏等症状。③代谢性疾病干预:6’-SL(6’-唾液酸乳糖)的研究为GNE肌病等与唾液酸代谢相关的疾病提供了潜在的营养干预思路。
5. 挑战与产业化路径
文章明确指出,当前HMOs产业化的核心瓶颈已从“合成”转向“分离”。发酵液成分复杂,存在大量结构相似的异构体(如LNT与LNnT)、未利用的碳源和宿主杂质(如内毒素、核酸)。现有实验室层析方法(如HILIC)难以直接放大。未来需重点开发集成膜过滤、离子交换和拟模板吸附的低成本、高分辨率纯化工艺。
此外,更复杂HMOs(如DSLNT)的合成仍面临巨大挑战,涉及多步、多位点的糖基化反应,对酶的协同性与途径的精准调控提出了极高要求。
局限性与展望:
1. 目前高纯度HMOs(尤其是复杂结构及异构体)的分离成本高昂。发酵产物中的宿主蛋白、内毒素、核酸以及结构相似的副产物(如LNT与LNnT)难以高效去除,制约了其在医药级高端领域的应用。开发低成本、高分辨率的集成纯化工艺(如连续层析、模拟移动床)是未来攻关重点;
2. 对于超过五糖的、具有分支或多次修饰(如岩藻糖化叠加唾液酸化)的复杂HMOs,其生物合成途径冗长,代谢流调控极为复杂,目前产率极低或无法合成,这限制了完全模拟母乳HMOs多样性的可能性;
3. 当前主流生产宿主大肠杆菌虽效率高,但其“工程菌”身份和潜在内毒素风险,在食品与医药应用中仍需严格论证。开发具有GRAS认证的酵母或枯草芽孢杆菌等底盘细胞,并实现与之匹配的高产工艺,是提升市场接受度的关键。
结语:
人乳寡糖(HMOs)的生物合成已从概念验证迈入规模化生产阶段,成为合成生物学与营养健康产业成功结合的典范。通过系统代谢工程、酶分子改造与发酵工艺优化,以2’-FL、LNnT为代表的简单HMOs已成功实现商业化,奠定了产业基础。当前,研究前沿正指向LNT、DFL、唾液酸乳糖等更复杂结构的高效制备,以及它们在医疗食品和慢性病营养干预中的高附加值应用。尽管面临下游分离纯化、复杂结构合成效率等产业化挑战,但跨学科技术的融合(如人工智能辅助酶设计、连续智能制造)正在不断突破这些瓶颈。未来,随着成本下降与应用场景的深化,HMOs有望从高端婴配粉的核心成分,演进为覆盖全人群、服务全生命周期的下一代功能性健康配料,开启精准营养的新篇章。
