一、中文标题
通过调控细胞代谢与形态实现可控分子量透明质酸的高产合成(Regulating cellular metabolism and morphology to achieve high-yield synthesis of hyaluronan with controllable molecular weights)
二、发表单位及通讯作者
· 发表单位:
o 江南大学生物技术学院,碳水化合物化学与生物技术教育部重点实验室
o 江南大学未来食品科学中心
o 江南大学食品科学与资源国家重点实验室
o 江苏省合成生物学基础研究中心
o 江苏产业技术研究院未来食品技术研究所
o 华南理工大学环境与能源学院
· 通讯作者:Zhen Kang(康振,邮箱:zkang@jiangnan.edu.cn)
三、发表时间
· 在线发表日期:2025年2月28日
四、摘要
透明质酸(HA)是一种重要的生物聚合物,其分子量决定其理化性质与生物功能。本研究系统解析了I类透明质酸合成酶(HAS)中参与聚合、分泌与分子量调控的关键区域,成功构建了能够实现HA完全分泌的突变体,将HA分子量调控范围扩展至300–1400 kDa。研究发现UDP-葡萄糖6-脱氢酶(Ugd)的过表达导致细胞分裂异常,呈现链杆状形态。通过动态调控Ugd表达并使用适应性进化策略,恢复了细胞正常生长并提升了其在高压环境下的代谢能力。最终,工程菌株C. glutamicum CGHA-125在补料分批培养中,高分子量HA(500 kDa)产量达45 g/L,低分子量HA(10 kDa)产量达105 g/L,产率分别为0.94 g/L/h和1.46 g/L/h。该研究深化了对HAS功能的理解,揭示了细胞形态与代谢之间的互作关系,为微生物细胞工厂的形态导向工程提供了新策略。
五、研究背景
透明质酸是由葡萄糖醛酸和N-乙酰葡萄糖胺重复单元构成的线性多糖,广泛分布于脊椎动物细胞外基质中,具有良好的保湿、润滑、修复及免疫调节等功能,广泛应用于化妆品、医药和食品工业。HA的理化性质与生物活性高度依赖其分子量,不同分子量的HA在医药与化妆品中有不同应用。传统HA生产主要依赖致病性链球菌,存在安全风险,因此构建非致病性重组菌株生产HA成为研究热点。
谷氨酸棒杆菌(C. glutamicum)作为GRAS微生物,代谢灵活、抗逆性强,已通过引入HAS、强化前体途径等方式被改造为HA生产菌株。然而,HA生物合成与细胞生长之间的平衡仍具挑战性,尤其在高压、高黏度环境下。此外,如何精准调控HA分子量也是实现其多样化应用的关键。HAS作为HA合成的关键酶,其结构功能尤其是跨膜通道与聚合机制尚不完全清楚。因此,深入解析HAS功能、平衡细胞代谢与形态、开发高效可控的HA合成平台具有重要意义。
六、研究结果
结果1、跨膜区域与脂质组成对HA外排至关重要
研究选用C. glutamicum为底盘宿主,引入S. zooepidemicus来源的HAS(SzHAS)后,细胞形态由典型杆状变为不规则形状,HA在胞内积累未分泌至培养基。进一步分析表明,HA积累导致细胞膜损伤,生长代谢停滞。膜脂质组学分析发现C. glutamicum膜中磷脂酰肌醇(PI)含量显著低于天然宿主,过表达PI合成酶部分恢复了细胞形态与膜完整性,说明膜脂质环境对HAS定位与功能具有关键调控作用。
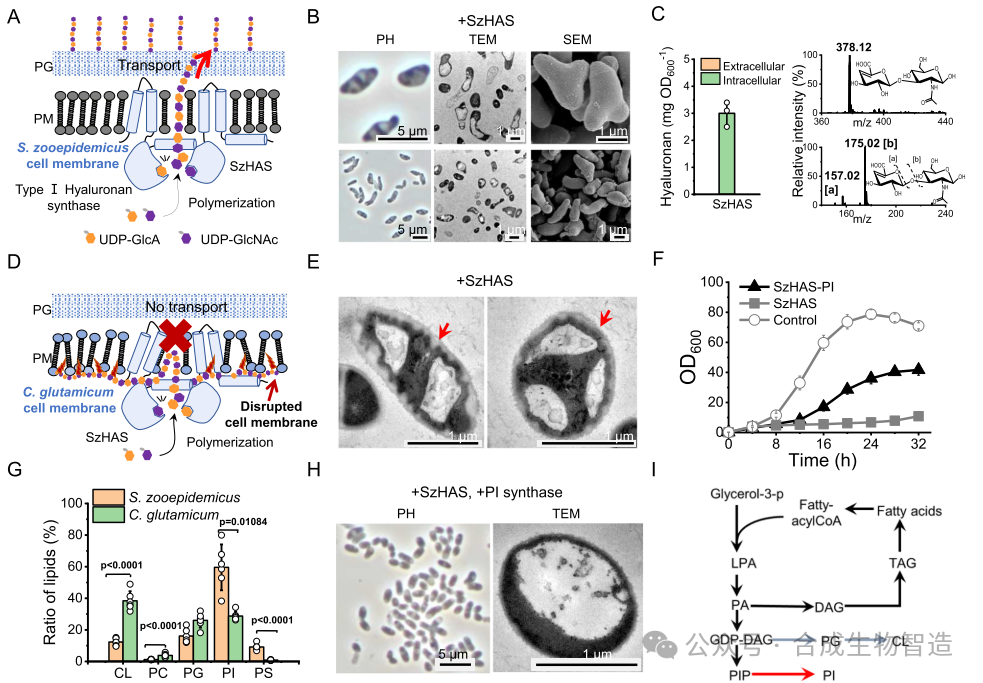
图1 谷氨酸棒杆菌积累透明质酸
结果2、跨膜螺旋TMH-1调控HA外运通道
通过对比SzHAS与S. pyogenes来源HAS(SpHAS)的结构与功能,发现仅替换TMH-1片段可使SzHAS恢复HA分泌能力。进一步结构模拟与突变分析表明,TMH-1虽不直接构成转运通道,但通过与TMH-2的相互作用调控通道构象,特别是残基W17(TMH-1)与L45(TMH-2)之间的疏水相互作用对HA外运起决定性作用。
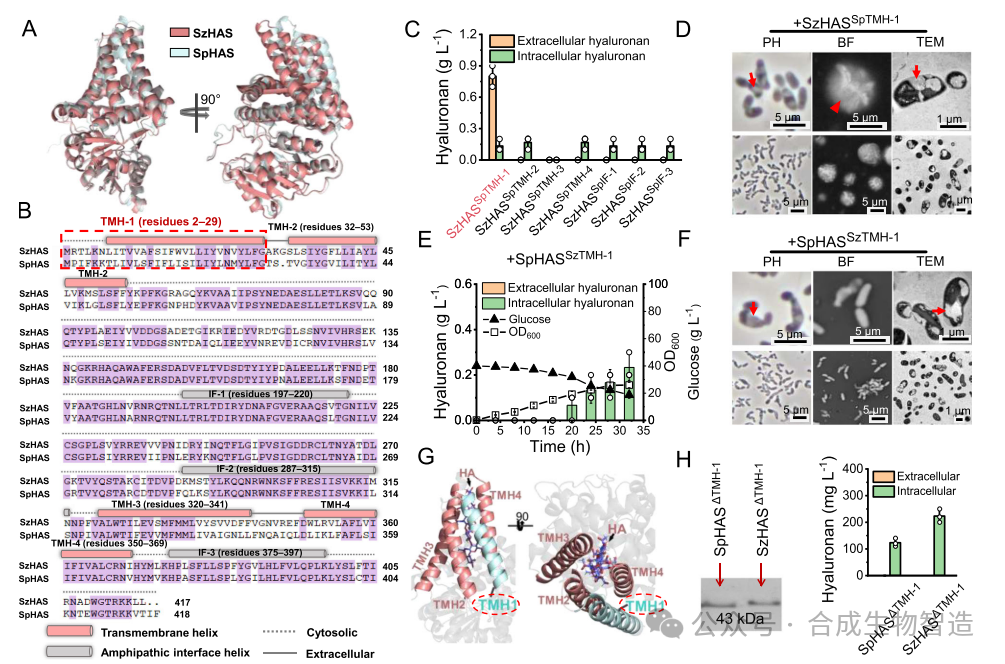
图2 TMH-1在跨膜转运中扮演重要作用
结果3、优化转运通道实现HA完全分泌与分子量控制
通过系统突变TMH-1及胞内N端区域,鉴定出多个关键残基(如N6、W17等),构建了突变体SzHAS2P/3I/4F/6R/17L,实现了HA的完全分泌,产量达1.9 g/L,且分子量可在300–1400 kDa范围内调控。研究发现,转运通道处于“半开放”状态时更有利于高分子量HA的合成与延长。
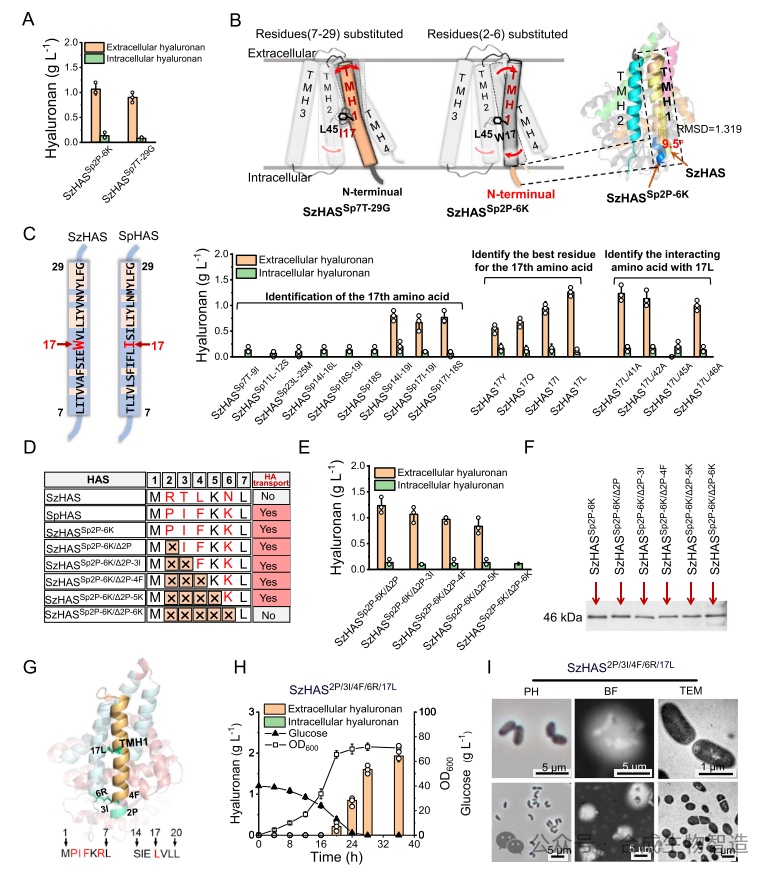
图3 TMH-1影响透明质酸跨膜转运
结果4、工程改造催化区域提升HA聚合能力
在已优化的突变体基础上,对催化区域中非保守位点进行定向进化,获得多位点突变体SzHAS2P/3I/4F/6R/17L/89V/90G/96W/108H/109D/243K,HA产量进一步提升至2.9 g/L。
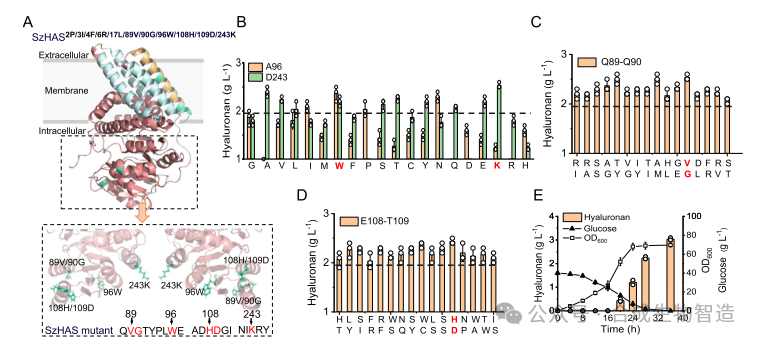
图4 工程化改造催化区域提高转运效率
结果5、动态调控UDP-GlcA合成以平衡细胞生长与HA生产
过表达Ugd导致C. glutamicum、E. coli和B. subtilis细胞呈现链杆状形态,细胞分裂受阻,生长受限。研究发现这源于UDP-GlcA合成与HA合成之间的时空调控失衡。通过构建晚期指数期响应型强启动子PH1动态调控Ugd表达,恢复了细胞正常形态与生长,同时将HA产量提高至10 g/L。
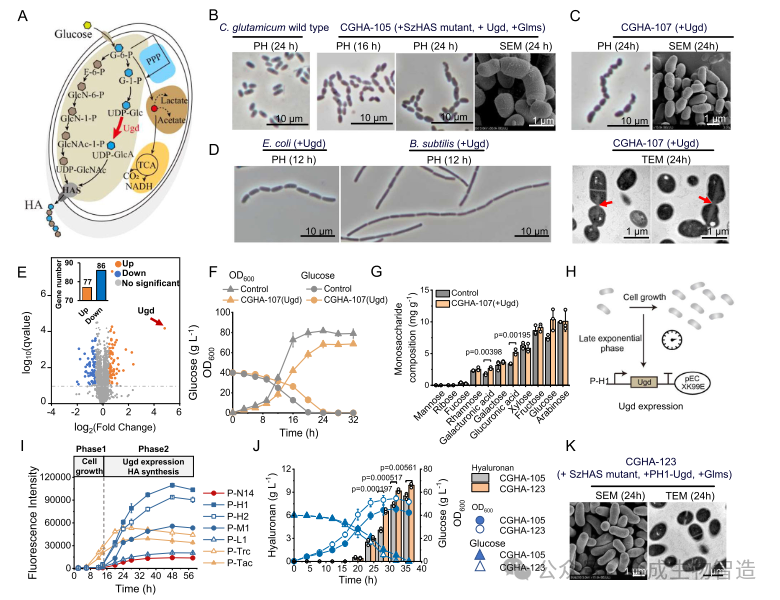
图5 平衡细胞生长和透明质酸合成
结果6、适应性进化提升菌株在高黏度环境中的生产能力
在补料分批培养中,随着HA积累,培养基黏度增加,菌株代谢能力下降。通过在高浓度HA环境中进行300代适应性进化,获得菌株CGHA-125,其在高黏度微厌氧条件下代谢能力显著提升,转录组分析显示乳酸合成、能量代谢与胁迫响应通路表达上调。最终在5 L发酵罐中实现45 g/L高分子量HA(500 kDa)生产。添加透明质酸酶(LHyal)降解HA后,低分子量HA(10 kDa)产量达105 g/L,转化率为27%。
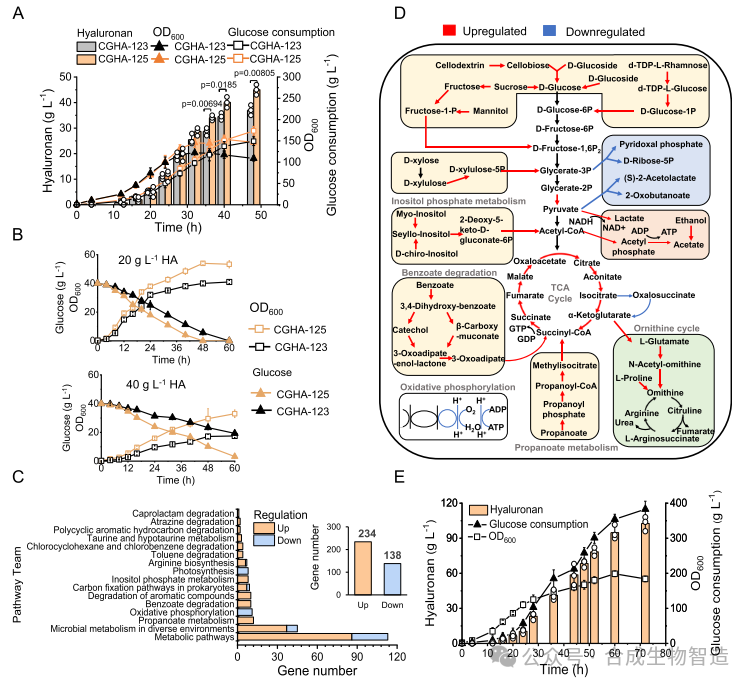
图6 适应性进化提高粘度耐受性
七、讨论
本研究通过系统解析HAS结构与功能,揭示了跨膜通道构象与脂质环境对HA分泌与分子量调控的关键作用,成功构建了完全分泌型HAS突变体,拓展了HA分子量的可控范围。研究还首次报道了UDP-GlcA合成增强导致细胞形态异常的现象,并通过动态代谢调控与适应性进化策略,有效协调了细胞生长与HA合成之间的平衡。这些发现不仅深化了对HAS工作机制的理解,也为多糖类化合物的微生物合成提供了形态-代谢协同调控的新视角。该研究开发的形态导向工程策略,为构建高效、稳定的微生物细胞工厂提供了重要参考,有望推动HA及其他高分子多糖的工业化生物制造。
