透明质酸酶催化透明质酸(Hyaluronic Acid, HA)的降解,透明质酸在医药、化妆品和食品行业的应用越来越多。透明质酸酶在微生物宿主中的重组表达作为替代动物组织来源的透明质酸酶的可持续方法已受到特别关注。
江南大学研究团队曾发表过通过工程蛋白易位和未折叠蛋白应答增强毕赤酵母rPH-20分泌。作者首先在组成型启动子PGCW14控制下实现该酶的基础表达,随后系统优化了内质网相关的分泌环节。通过采用ost1-proα信号肽将蛋白导向共翻译易位途径,使分泌水平提升20%。而且进一步过表达信号识别颗粒组分以增强共翻译效率,使分泌能力再提高48%。在此基础上,通过激活未折叠蛋白反应,过表达转录因子ScHac1p使胞外酶活达到4.06U/mL,较原始菌株提高2.1倍。最终经补料分批发酵,透明质酸酶产量进一步提升至19.82U/mL。该组合策略为增强酵母宿主中复杂蛋白的分泌提供了有效方案。
01
一、 引言
重组人透明质酸酶PH-20在医药、食品及化妆品工业中具有广泛应用前景,然而其在微生物表达系统中的产量限制制约了商业化应用。本研究以毕赤酵母为表达宿主,通过系统改造内质网相关分泌途径以提升rhPH-20的分泌效率(图1)。研究首先采用ost1-proα信号肽优化蛋白质导向,使分泌水平提升20%。随后作者通过增强信号识别颗粒(Signal Recognition Particle, SRP)介导的共翻译易位途径,进一步将分泌能力提高48%。在优化早期分泌途径的基础上,通过过表达酿酒酵母来源的ScHac1p转录因子激活未折叠蛋白反应,显著改善了蛋白质折叠能力,使胞外酶活达到4.06U/mL,较原始菌株提高2.1倍。最终通过补料分批发酵工艺优化,将rhPH-20产量进一步提升至19.82U/mL。本研究建立的分泌途径工程策略不仅实现了rhPH-20的高效生产,也为毕赤酵母中其他复杂重组蛋白的分泌表达提供了重要参考。
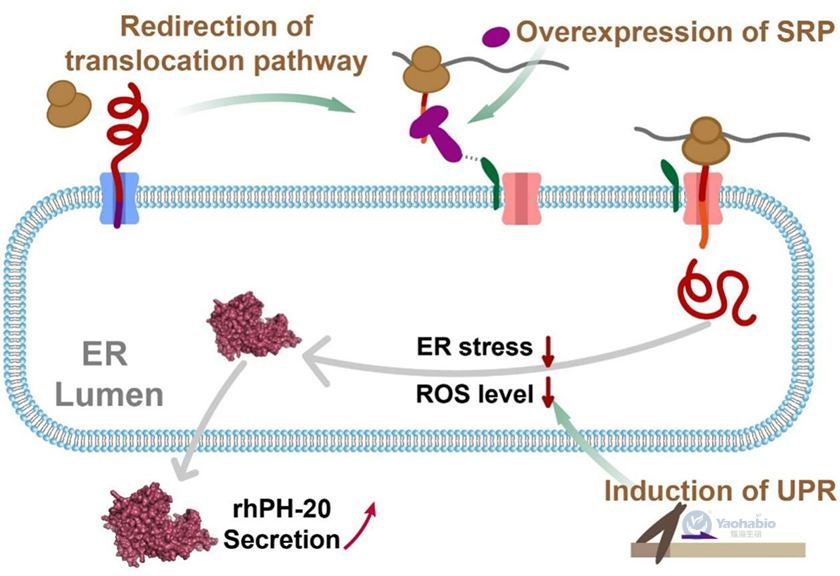
图1 本文涉及的蛋白质分泌途径概述
02
二、基于PGCW14系统的rhPH-20组成型表达载体构建
本研究成功构建了基于强组成型启动子PGCW14的rhPH-20组成型表达系统。首先通过分子克隆技术将rhPH-20基因插入改造后的pGCZαA载体,该载体以PGCW14启动子替代了原始pGAPZαA的PGAP启动子。在载体线性化过程中,针对pGCZαA衍生物采用反向聚合酶链式反应(Polymerase Chain Reaction,PCR)方法,而对pGAP3.5K衍生物则使用Nco I内切酶于HIS4位点进行酶切。随后通过电穿孔法将线性化载体转化至毕赤酵母GS115感受态细胞,并在含Zeocin的YPD平板上筛选转化子,其中单拷贝菌落通过MD平板直接筛选获得。最终获得的重组菌株GS115/PGCZα-PH20经发酵72小时后,其透明质酸酶活性达到2.01U/mL。蛋白质印迹分析显示(图2b),带有His6标签的rhPH-20在100kDa以上区域呈现信号条带,明显高于其理论分子量53.58kDa,这与该蛋白含有多个潜在N-糖基化位点的预测相符。该载体构建采用了一步克隆及反向PCR等技术,为后续分泌途径工程研究奠定了基础。
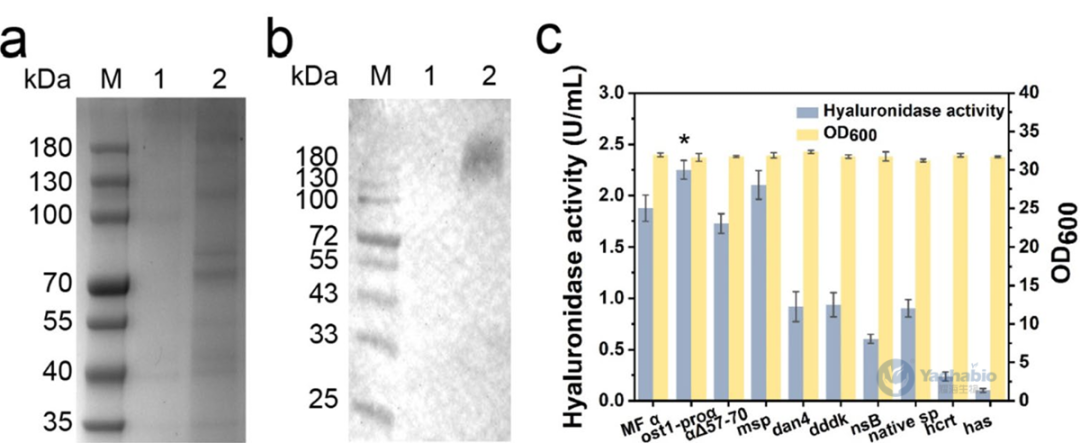
图2 rhPH-20在P. pastoris GS115中的表达和信号肽优化
03
三、优化rhPH-20分泌表达的信号肽筛选
完成载体构建后,作者通过系统筛选与优化信号肽以增强rhPH-20的分泌表达。在保留原始MFα信号肽结构的基础上,测试了包括多种信号肽。结果表明,不同信号肽对菌体生长均无显著影响(图2c)。与直接替换相比,对MFα进行结构修饰显示出更优效果。其中ost1-proα嵌合信号肽通过将蛋白质导向共翻译易位途径(图3a),使rhPH-20分泌量提升20%,而小鼠唾液淀粉酶信号肽也使产量提高12.1%。值得注意的是,人PH-20天然信号肽虽可引导分泌,但效率仅为MFα的51.9%。本研究证实信号肽工程,特别是导向共翻译途径的修饰策略,可有效提升复杂蛋白在毕赤酵母中的分泌效率。
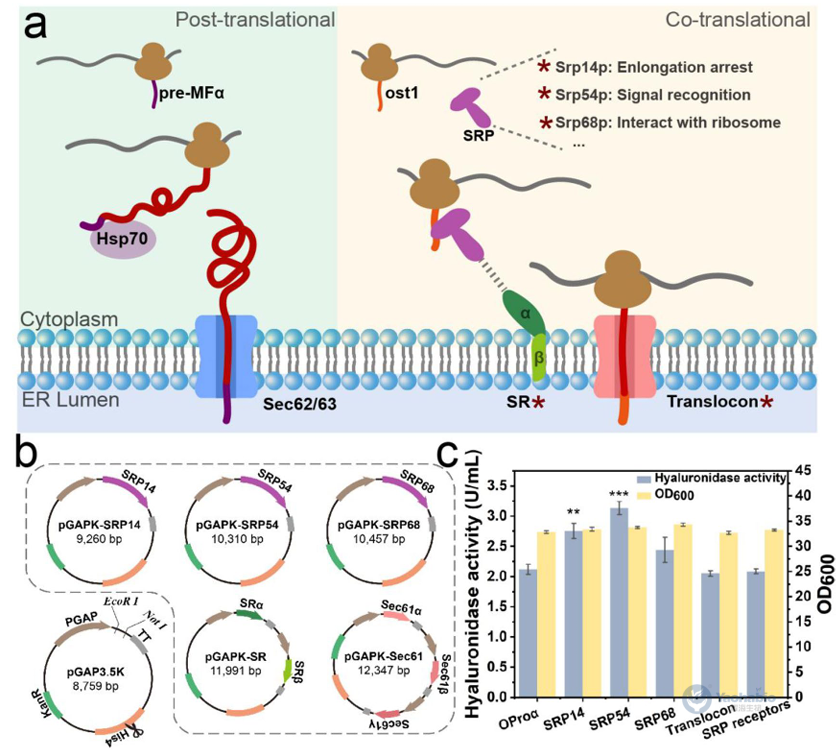
图3 优化和工程化rhPH-20分泌的易位途径
04
四、rhPH-20分泌的增强与改善
在优化信号肽的基础上,本研究进一步通过强化内质网易位途径与激活未折叠蛋白反应(Unfolded Protein Response, UPR)提升rhPH-20分泌效率(图3a)。首先在ost1-proα菌株(OProα)中过表达SRP组分,发现过表达SRP54可使酶活提升至3.14U/mL,较OProα提高1.48倍(图3c),而SRP14与SRP68亦分别提升29.7%与15.3%。随后,通过共表达SRP54与来源于三种真核生物的HAC1基因,进一步激活UPR通路。其中共表达SRP54与酿酒酵母ScHAC1的菌株(OE54-ScHAC1)效果最优,摇瓶发酵后酶活达4.06U/mL(图5a),较原始菌株提高约2倍。单独过表达ScHAC1亦使产量提升1.51倍(图5b),且蛋白质印迹结果与酶活数据一致(图5c)。结果表明,协同强化共翻译易位与UPR可显著增强复杂真核蛋白在毕赤酵母中的分泌能力。
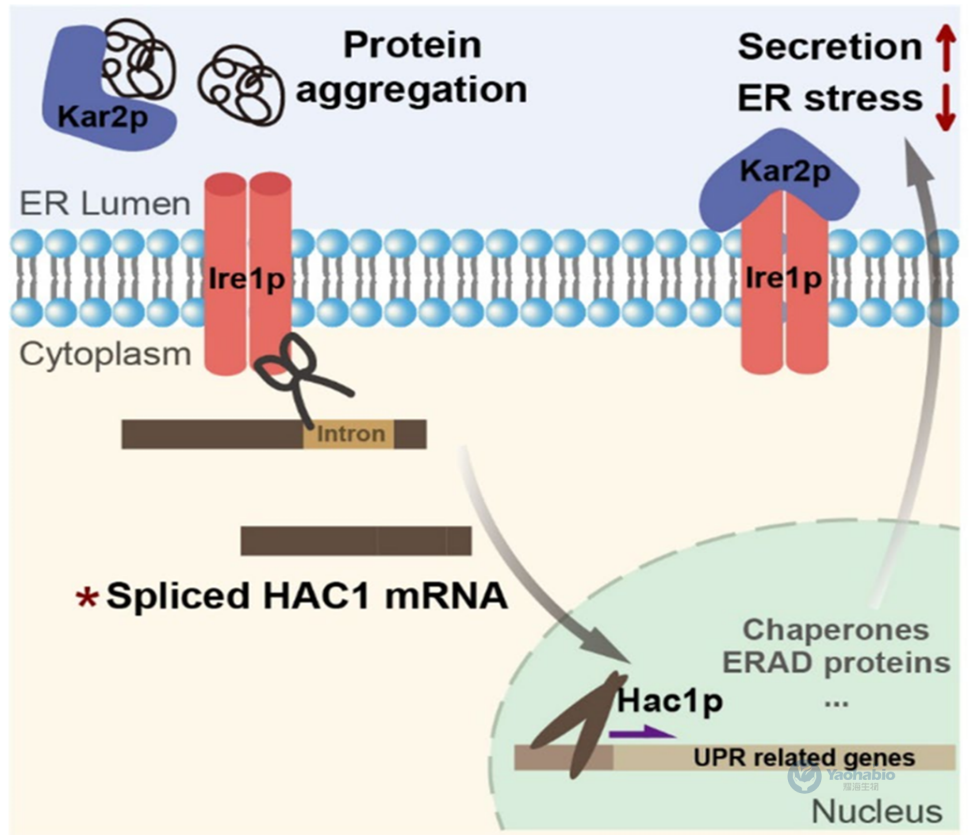
图4 酵母中UPR的激活过程
为阐明ScHAC1过表达促进分泌的机制,作者分析了UPR激活与活性氧(Reactive Oxygen Species, ROS)水平变化。RT-PCR结果显示(图5e),在共表达ScHAC1的菌株中,UPR关键基因ERO1、PDI1和KAR2的转录水平显著上调,同时内源性HAC1与应激基因MSN2表达下调,表明UPR被有效激活且内质网应激得到缓解。值得注意的是,rhPH-20的转录水平未发生显著变化(图5d),证实产量提升源于分泌效率的改善而非表达量增加。在氧化应激方面,过表达Srp54p使细胞内ROS水平升高5.83倍,而共表达ScHAC1则使ROS水平降低62.9%(图6a),伴随SOD1、SOD2和过氧化氢酶基因表达下调(图6b)。通过外源添加H₂O₂实验进一步验证,ROS水平升高会显著抑制rhPH-20分泌(图6c,d),表明ScHAC1过表达通过缓解氧化应激为重组蛋白分泌创造了更有利的细胞环境。
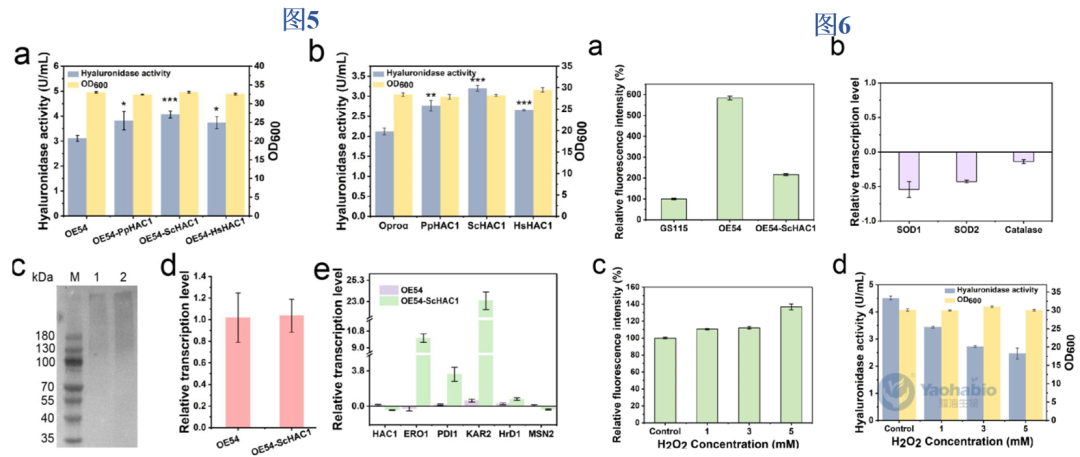
图5/图6 HAC1过表达对rhPH-20分泌和UPR的
影响/ScHAC1过表达对ROS水平的影响
05
五、优化菌株的发酵优化和放大发酵
文章的最后,作者对构建的高产菌株OE54-ScHAC1进行了系统的发酵工艺优化。首先在摇瓶水平采用单因素优化策略,依次考察了甘油浓度、培养温度和接种量等关键参数对菌体生长和产物分泌的影响。实验结果表明,当使用含40g/L甘油的改良BMGY培养基,以10%的接种量在20℃条件下培养96小时,可获得最佳发酵效果,此时rhPH-20分泌量达到4.99U/mL(图7)。这一优化条件有效平衡了菌体生长与蛋白分泌的需求,为放大生产奠定了基础。在5L发酵罐中进行补料分批发酵研究时,作者通过精确控制甘油补料策略,使得rhPH-20产量持续稳定增长,在120小时达到峰值,酶活为19.82U/mL(图8)。这一产量较优化前的摇瓶水平提升了约4.9倍,显著高于文献报道的同类组成型表达菌株在YPD培养基中的产量2U/mL。该结果充分证明了经过分泌途径工程改造的菌株在放大生产过程中的稳定性与高效性,为rhPH-20的工业化生产提供了可靠的技术方案。
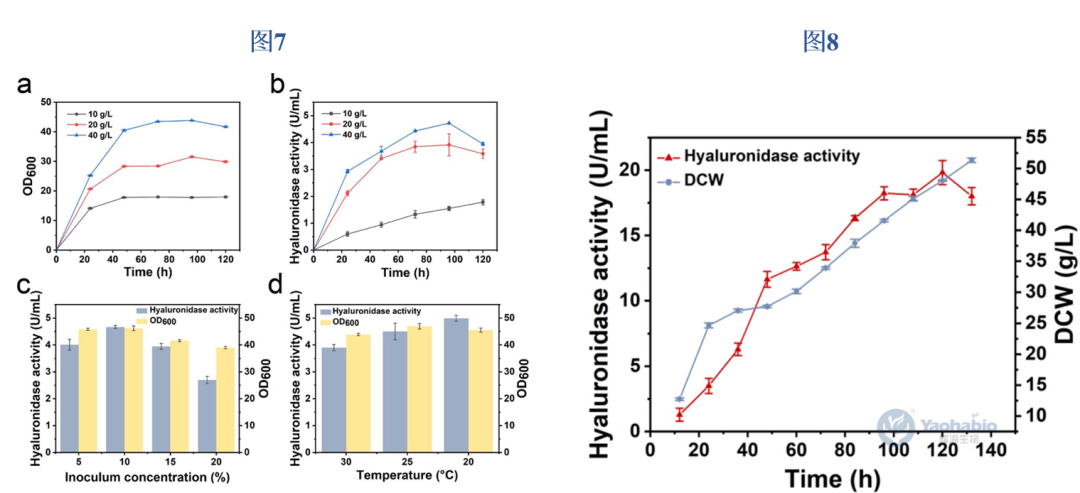
图7&图8 优化菌株的发酵优化和放大发酵
结语
本研究通过在毕赤酵母中采用内质网通路组合工程策略,成功构建了rhPH-20高分泌菌株。首先,通过筛选多种信号肽,发现杂交信号肽ost1-proα能有效引导rhPH-20进入共翻译易位途径,从而提高其内质网导入效率。进一步过表达信号识别颗粒组分Srp54p,使rhPH-20分泌提升最高达48%,表明在毕赤酵母中,共翻译易位能力是限制蛋白分泌的关键瓶颈之一。在翻译后加工层面,过表达酿酒酵母来源的ScHac1p可显著激活未折叠蛋白应答。相关基因如KAR2、ERO1、PDI1等在转录水平明显上调,提示内质网伴侣与折叠能力增强,内质网应激得以缓解。同时,ScHac1p过表达还显著降低了胞内活性氧水平,外源添加H₂O₂实验也证实氧化应激会对rhPH-20分泌造成负面影响,说明该策略通过缓解氧化应激为蛋白分泌提供了保护性环境。最终,结合共翻译易位途径强化与ScHac1p介导的UPR激活,本研究在5L发酵罐中使rhPH-20的透明质酸酶活性提高至19.82U/mL。该研究不仅为rhPH-20的经济化生产奠定了基础,也为毕赤酵母中其他重组蛋白的高效分泌提供了可借鉴的双通路协同优化策略。
