1. 研究导读:突破透明质酸体外合成的瓶颈
透明质酸 (Hyaluronic acid, HA) 是一种由 D-葡萄糖醛酸 (GlcA) 和 N-乙酰D-葡萄糖胺 (GlcNAc) 重复二糖单元(β-1,3-GlcA 和 β-1,4-GlcNAc 交替连接)组成的线性多糖。凭借其优异的生物相容性、非免疫原性和卓越的保湿能力,HA 在生物医学、化妆品和食品工业中获得了广泛的应用。
目前,HA 的工业生产主要依赖于兽疫链球菌 (Streptococcus zooepidemicus) 的微生物发酵。然而,这种生产方式面临两大挑战:首先,该菌株的致病性引发了生物安全方面的担忧;其次,其遗传难操作性极大地限制了通过基因工程手段优化 HA 产率的努力。
为了应对这些挑战,无细胞的体外酶法合成 (cell-free enzymatic synthesis) 成为了一种极具吸引力的替代策略。该方法在体外重建简化的酶促途径,摆脱了细胞壁和细胞膜等物理屏障,规避了宿主细胞复杂的代谢网络。因此,酶法合成具有高精度、强可控性和高产物纯度(如内毒素污染极低)等显著优势,并能简化下游纯化流程。
尽管体外合成潜力巨大,但其广泛应用长期以来受到一个关键瓶颈的制约:高昂的底物成本。HA 的生物合成依赖于两种活化的核苷酸糖前体——UDP-GlcNAc 和 UDP-GlcA。这些高价值化合物的市场价格非常昂贵,使得依赖其作为起始原料的体外合成在经济上不具备可行性。因此,开发一种能够利用廉价原料、经济高效地原位合成这些前体的系统,是实现 HA 体外合成规模化生产的核心难题。
2. 核心策略:构建八酶级联的“一锅法”合成系统
本研究的作者们设计并建立了一个精巧的无细胞酶促级联系统,通过八种途径酶 (eight pathway enzymes),将 HA 的从头合成 (de novo synthesis) 与前体供应及核苷酸回收 (nucleotide recycling) 整合在同一个反应体系中。
该系统的总体蓝图如方案1所示,它巧妙地分拆为三个协同作用的功能模块:
· 模块一:前体合成模块。利用核苷酸糖补救途径 (salvage pathways),以廉价的单糖 GlcNAc 和 GlcA 为起始原料,在 ATP 和 UTP 存在下,通过四种酶(NahK, GlmU, GlcAK, USP)高效合成 HA 的两大直接前体:UDP-GlcNAc 和 UDP-GlcA。
· 模块二:聚合模块。利用核心的透明质酸合酶 (HAS),催化模块一提供的等摩尔前体,交替进行糖基转移,聚合成高分子量的 HA 链。
· 模块三:辅因子再生模块。这是确保系统经济性的关键。利用三种酶 (PPK3, URA6, PmPpA) 构成的循环,持续再生反应中消耗的昂贵辅因子 ATP/UTP,同时清除抑制性副产物。
该研究所选用的全部八种关键酶的详细信息,包括其来源、EC 编号和催化的反应,总结于表1中。
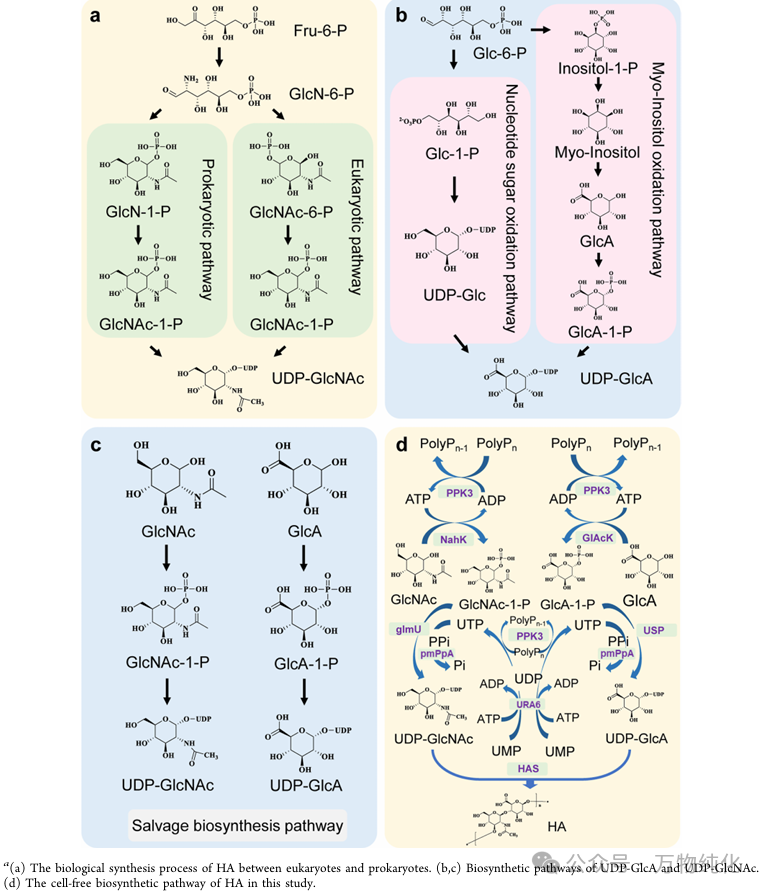
方案1. HA 前体分子的合成代谢途径和本研究中的 HA 无细胞生物合成途径
表1. 本研究中用于 HA 合成的候选酶

在该系统中,每一个酶都至关重要。特别值得注意的是无机焦磷酸酶 (PmPpA) 的加入。在前体合成模块中,GlmU 和 USP 的反应都会产生副产物焦磷酸 (PPi)。根据化学平衡原理,PPi 的积累会抑制这两个反应的正向进行,从而“堵塞”整个 HA 合成通路。PmPpA 的功能就是水解 PPi,将其转变为磷酸盐 (Pi),从而解除这一抑制效应,强有力地“拉动”反应平衡向产物方向移动,确保了前体合成的高效进行。
3. 模块一:HA前体 (UDP-GlcNAc/UDP-GlcA) 的补救合成与优化
在构建完整系统之前,作者首先对模块一(前体合成)进行了细致的优化 (3.1. Setup of the UDP-GlcNAc and UDP-GlcA Synthesis Reactions)。如方案2所示,该模块包含两条平行的酶法路径,分别用于合成 UDP-GlcNAc 和 UDP-GlcA。图1b的 SDS-PAGE 结果证实了模块一所需的四种酶(来自Bifidobacterium longum的 BlNahK、来自Escherichia coli的 EcGlmU、以及来自Arabidopsis thaliana的 AtGlcAK 和 AtUSP)均获得了成功的异源表达和纯化。
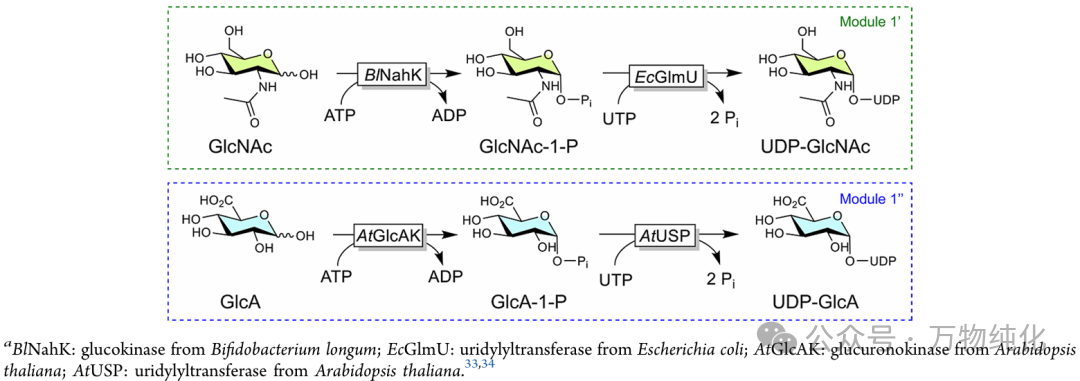
方案2. HA前体的酶法合成
随后,作者对该模块进行了两轮关键优化:
3.1 底物比例优化
作者首先探究了起始底物(单糖, ATP, UTP)的摩尔比例对两种前体产率的影响。如图1c和图1d所示:
· 对于 UDP-GlcNAc 的合成,当 GlcNAc/ATP/UTP 的摩尔比为 1:1:1 时,获得了最高的产率 (46%)。
· 对于 UDP-GlcA 的合成,则是在 GlcA/ATP/UTP 摩尔比为 2:1:1 时,产率最高 (36%)。
这一结果清晰地表明,两条平行通路具有不同的最适底物需求。
3.2 酶载量优化:从“最大化产率”到“平衡通量”
上述差异化的最适比例带来了一个新问题:下游的 PmHAS 聚合反应需要等摩尔 (equimolar) 的 UDP-GlcNAc 和 UDP-GlcA。如果简单地按照各自的最优条件生产,必然会导致一种前体过剩而另一种前体不足,从而限制 HA 的总产量。
因此,作者的策略目标从“最大化单一产率”转变为“实现相似的形成速率以平衡通量”。为此,他们系统地改变了四种生物催化剂 (BlNahK, EcGlmU, AtGlcAK, AtUSP) 的比例 (mg/mL)。如图1e所示,最终找到了一个“黄金比例”:当四种酶的比例为 1:1.5:1.5:2 (BlNahK:EcGlmU:AtGlcAK:AtUSP) 时,系统达到了理想的平衡状态:UDP-GlcNAc 的转化率达到 79.7%,而 UDP-GlcA 的转化率达到 68.6%。在这一条件下,两条通路能够以相似的速度稳定地供给下游所需的两种前体。
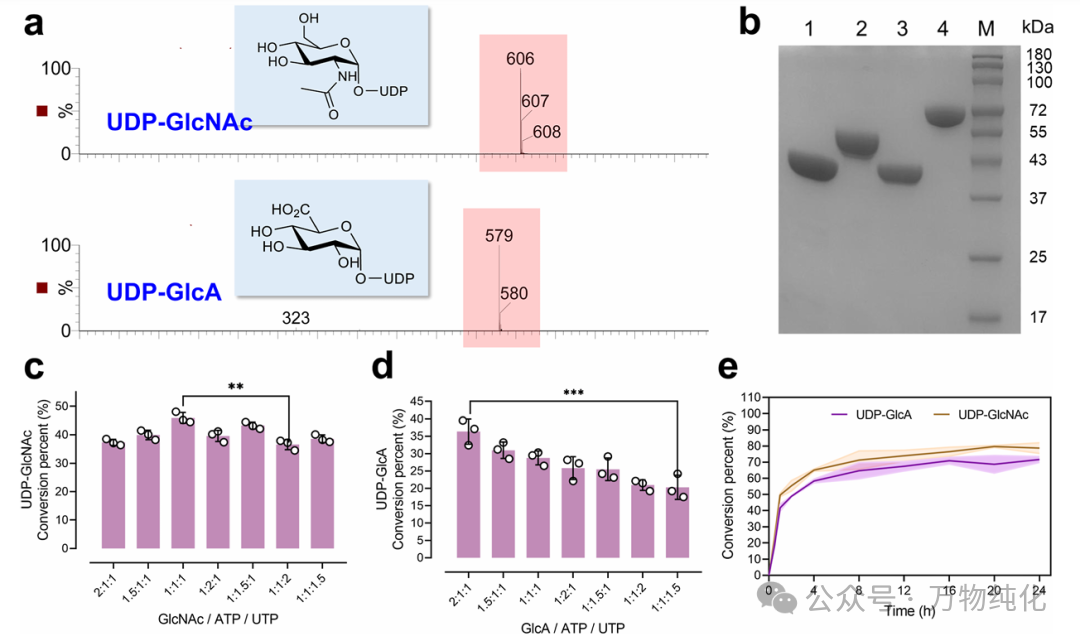
图1. UDP-GlcNAc和UDP-GlcA合成的组合优化
4. 模块二:关键酶PmHAS的可溶性表达与产物表征
解决了前体供应问题后 (3.2. Cell-Free Biosynthesis of HA),研究团队转向了核心的聚合酶——来自Pasteurella multocida的 PmHAS。这是一个巨大的挑战:PmHAS 是一种膜相关蛋白 (membrane-associated protein),其序列中含有疏水区域。这些区域在活细胞中对于引导 HA 链跨膜转运至关重要,但在体外的水相反应体系中,它们会导致蛋白质的错误折叠、聚集和失活,使其难以实现可溶性表达。
4.1 截短突变体的理性设计与筛选
为解决这一关键的溶解性问题,作者采用了一种现代生物工程策略:截短其膜相关结构域。他们首先使用了一个名为 DeepSoluE 的深度学习算法,in silico(通过计算)预测了一系列不同截短突变体的溶解度。构建的截短体包括 PmHASA2-45, PmHASA2-75, PmHASA2-95, PmHASA710-972, PmHASA800-972 和 PmHASA900-972。
如图2a的预测结果所示,PmHASA710-972(即去除了 N 端和 C 端的特定疏水区)被预测具有最高的溶解度。随后的实验验证(图2b的 SDS-PAGE 分析)完美证实了这一预测:只有 PmHASA710-972 突变体成功实现了可溶性表达,为后续的体外合成奠定了基础。
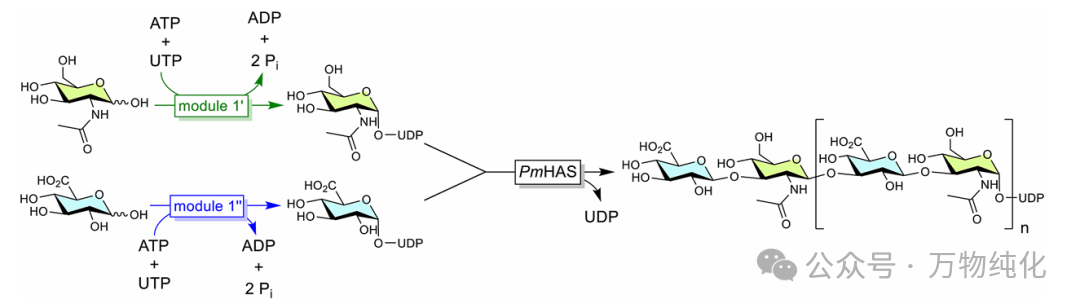
方案3. 通过HAS的原位活化核苷酸前体合成HA
4.2 产物HA的严格表征
利用可溶的 PmHASA710-972 酶和模块一的前体,作者在方案3所示的级联反应中成功合成了HA。为了确证产物的身份,进行了严格的化学和生物化学表征:
1. 红外光谱 (IR) 分析 (图2c):将合成产物的 IR 光谱与 HA 真实参考标准品(European Pharmacopoeia)进行对比。结果显示,两条图谱完全匹配 (matched),证明合成产物具有 HA 特有的化学官能团结构。
2. 酶降解与质谱 (LC-MS) 分析 (图2d):这是更具特异性的“指纹”鉴定。研究团队使用透明质酸酶 (hyaluronidase)——一种特异性降解 HA 的酶——处理合成产物。LC-MS 分析显示,经过4小时的酶解,高分子量的 HA 被完全降解,只产生了一个单一的、占绝对主导地位的峰,其质荷比 (m/z) 为 377。这个值与 HA 的二糖重复单元 (GlcNAc-GlcA) 的理论分子量完全一致。
这两项证据(化学结构匹配和生物学特异性降解产物一致)强有力地证明了该无细胞系统合成的产物确切无疑是透明质酸。
4.3 产物分子量
凝胶渗透色谱法 (GPC) 分析表明,合成的 HA 产物分子量 (MW) 分布较广,范围从 1.28 × 104 Da 到 1.02 × 106 Da。产物主要由三种组分构成:1.28 × 104 Da (占51%), 1.33 × 105 Da (占36%), 和 1.02 × 106 Da (占13%)。作者指出,虽然合成是成功的,但如何调控这一分子量分布以满足不同应用的需求,将是未来需要进一步优化的方向。
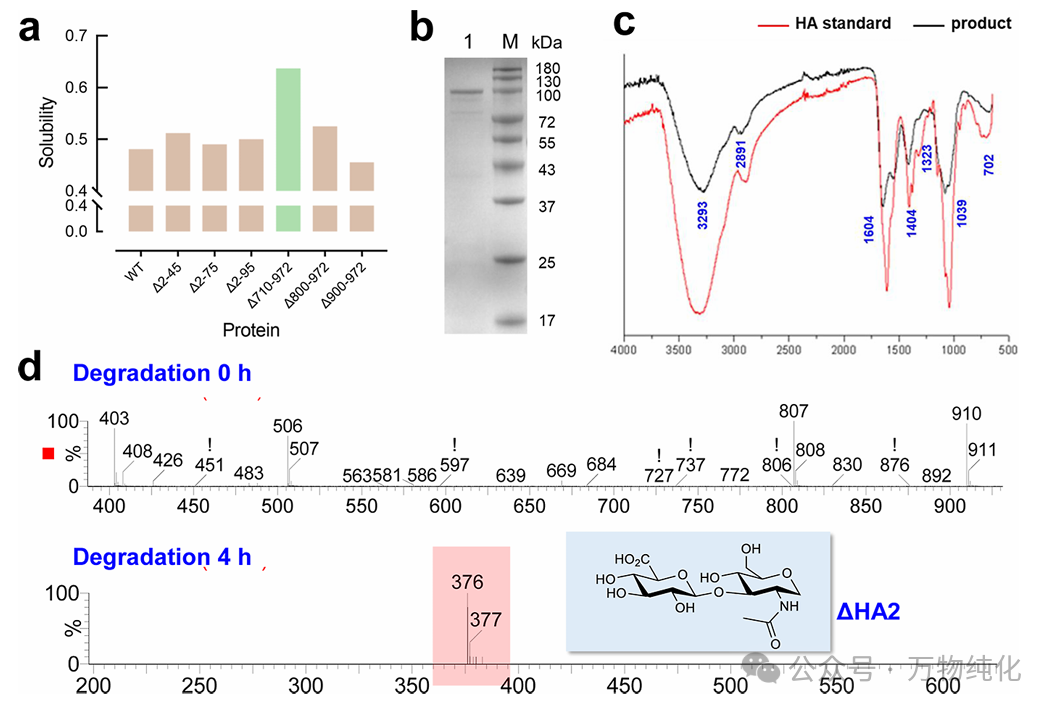
图2. HA的合成与产物表征
5. 模块三:降低成本的核心——ATP/UTP双循环再生系统
虽然模块一和模块二已经能合成 HA,但其反应仍然化学计量地消耗昂贵的 ATP 和 UTP,不具备经济可行性。因此,模块三(辅因子再生) (3.3. Construction of a Nucleotide Sugars Recycling System) 是本研究从“可行”走向“实用”的胜负手。
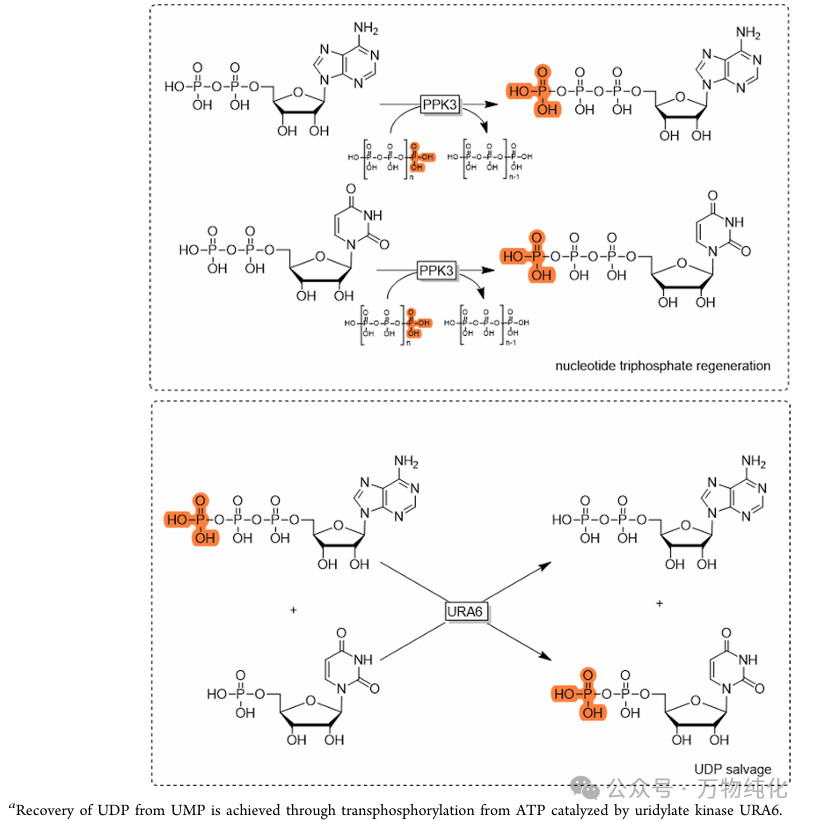
如方案4所示,作者设计了一个精巧的双循环再生系统,其核心组件包括:
· 多聚磷酸盐激酶 (PPK3):它以极其廉价的多聚磷酸盐 (PolyP) 作为磷酸供体,将反应中生成的 ADP 和 UDP 分别再生为 ATP 和 UTP。
· 尿苷酸激酶 (URA6):系统中的“废物”UMP(由 PmHAS 反应或 UDP 分解产生)可被 URA6 利用 ATP 再生为 UDP,随后 UDP 再进入 PPK3 循环,被转化为 UTP。
图3a的 SDS-PAGE 结果证实了这三种再生酶(RpPPK3, PmPpA, AtURA6)均成功表达。
方案4. 提出的利用多聚磷酸盐激酶(PPK3)从其二磷酸核苷中原位再生ATP和UTP的途径
该系统的有效性通过对比实验得到了有力证明:
· 对照组 (无回收系统,图3c):如图所示,在没有回收系统时,ATP 和 UTP 在反应开始后被迅速消耗,导致其二磷酸(ADP, UDP)和单磷酸(UMP)形式的大量积累。
· 实验组 (有回收系统,图3d):该系统的强大之处在于,它甚至可以仅使用最廉价的 UMP 作为起始底物。图3d显示,加入回收系统后,UMP 在短短 0.5 小时内就被迅速转化为 UDP 和 UTP,证明了该循环极高的再生效率。
更重要的是,当回收系统启动后,ATP 的净消耗量显著降低。数据显示,在反应12小时后,回收系统中产生的 ADP 仅为无回收系统时的 53.6%。这证明该系统成功地将昂贵的 ATP/UTP 从化学计量的“消耗品”转变为催化量的“穿梭载体”,极大地降低了成本。
6. 全系统整合:HA的从头合成与最终产率
最后 (3.4. Cell-Free Enzyme Cascade for the De Novo Synthesis of HA),作者在 50 mL 反应体系中,将所有三个模块(前体合成 + 聚合 + 辅因子再生)进行了整合,实现了 HA 的从头合成。
该过程采用了一种巧妙的两步序贯添加策略:
1. 第 0-8 小时:首先运行模块一和模块三。如图3e所示,在 8 小时内,UDP-GlcNAc 和 UDP-GlcA 的产率均超过了 60%。这一步的目的是“预充电”,为后续的聚合反应积累高浓度的底物。
2. 第 8-24 小时:在第 8 小时,加入核心的聚合酶 PmHAS(模块二)。
这一策略背后的工艺逻辑是:通过先积累高浓度的前体,可以确保 PmHAS 在加入后处于底物饱和状态,从而以最高效率驱动聚合反应,并可能有助于合成更高分子量的产物。
最终的生产动力学如图3f所示:在第8小时加入 PmHAS 后,前体(UDP-GlcNAc 和 UDP-GlcA)浓度开始迅速下降,而被消耗的前体则被转化为 HA,导致 HA 产量稳步增加。在反应 24 小时后,HA 的最终产率达到了 1.28 g/L。
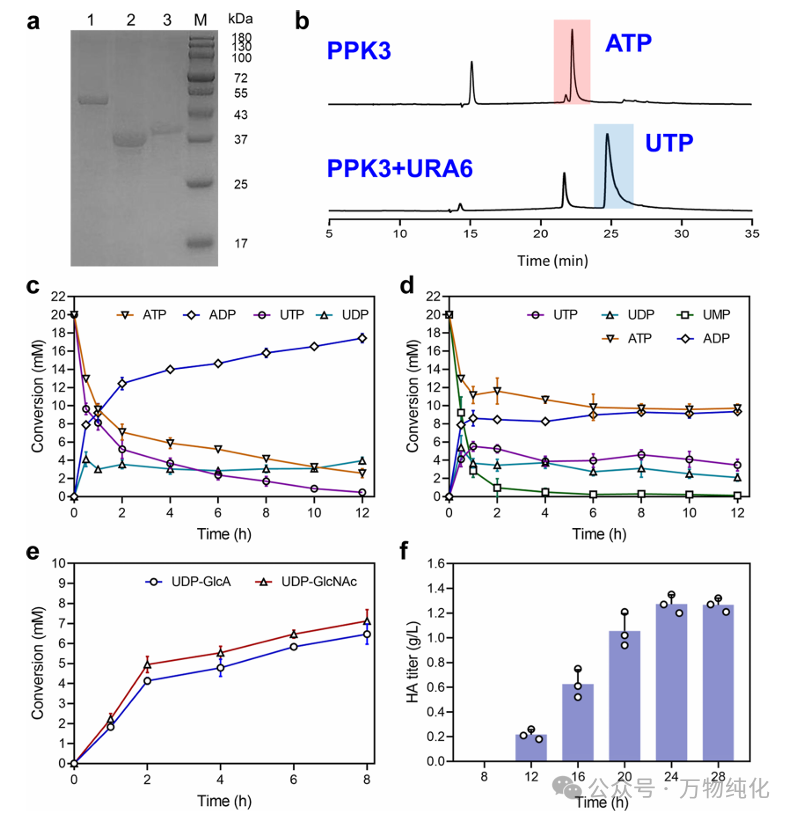
图3. 核苷酸循环系统的构建与验证
7. 总结与展望
本研究成功开发了一个集成了前体合成、聚合和辅因子再生的无细胞酶促级联系统,用于经济高效地合成透明质酸。该系统利用五种关键途径酶将低成本底物 (GlcNAc 和 GlcA) 转化为高价值的 HA,并通过“一锅法”中耦合的核苷酸回收模块 (PPK3, URA6, PmPpA),消除了对昂贵核苷酸糖进行纯化的需求,同时解决了 PPi 的抑制问题。
最终,该优化系统在 24 小时内实现了 1.28 g/L 的 HA 产量,底物转化率达到 65.9%,产物分子量范围为 1.28 × 104 至 1.02 × 106 Da。
这项工作不仅为 HA 的规模化生产提供了一个具有成本效益的平台,更重要的是,它建立了一个模块化的酶促蓝图 (modular enzymatic blueprint)。理论上,通过替换模块一和模块二中的关键酶(例如,使用其他糖基转移酶和相应的 UDP-糖合成酶),该平台可以被改造用于工程化其他高价值的糖胺聚糖 (glycosaminoglycans),在合成糖生物学领域展现了广泛的应用前景。
