近日,Microbial Biotechnology发表了江南大学糖化学与生物技术教育部重点实验室刘延峰研究员课题组的研究成果“Reconstitution of methionine cycle with ATP regeneration for whole-cell catalysis of creatine production in engineered Escherichia coli”(Sheng et al., Microbial Biotechnology, 2025, 18: 70145)。2022级硕士生盛宇华为论文第一作者,刘延峰研究员为通讯作者。
肌酸(Creatine,CR)是一种天然存在于脊椎动物体内的氨基酸衍生物,是一种重要的能量缓冲剂,具有改善机体能量代谢、促进肌细胞发育等生物学功能,已被应用于食品、医药等领域。目前,CR的主要通过化学合成法生产,合成路径存在反应时间长、操作过程复杂等问题。而全细胞转化法有着高生产率、下游处理简单等优点,是实现CR绿色、可持续生产的重要途径,但主要存在以下三方面问题:首先是大肠杆菌中CR合成途径的缺乏;其次是底物的高昂成本限制及副产物的抑制作用;最后是甲基供体S-腺苷蛋氨酸的合成受限。
为解决上述问题,该研究以Escherichia coli BL21(DE3)作为表达宿主,首先通过关键酶来源筛选确定使用Amycolatopsis kentuckyensis来源的L-精氨酸:甘氨酸脒基转移酶(AGAT)及Mus caroli来源的胍基乙酸N-甲基转移酶(GAMT),并通过双酶共表达策略优化进一步构建CR合成途径;基于中间产物胍基乙酸的严重积累现象,通过不同强度RBS筛选及构建N-端编码序列同义突变文库策略对关键限速酶GAMT进行表达水平优化;最后,结合模块化代谢工程策略,通过重构鸟氨酸循环强化底物再生及解除副产物的抑制作用,并针对甲基供体S-腺苷蛋氨酸合成受限于ATP不足的难题,通过引入来自Staphylococcus epidermidis的多磷酸激酶(PPK2)、来自Saccharomyces cerevisiae的S-腺苷高半胱氨酸水解酶(ScSAH)和腺苷激酶(ADO1)构建由腺苷到ATP的生物合成模块,得到CR产量大幅提升至3.38 g/L。进一步进行全细胞转化条件优化及3 L生物反应器水平转化,得到在全细胞转化24 h后终产物CR产量为5.27 g/L,最高生产强度为0.8 g/L/h,从而构建了高效合成CR的重组E. coli工程菌。
上述研究工作得到了国家优秀青年科学基金和江苏省合成生物基础研究中心等项目的资助。
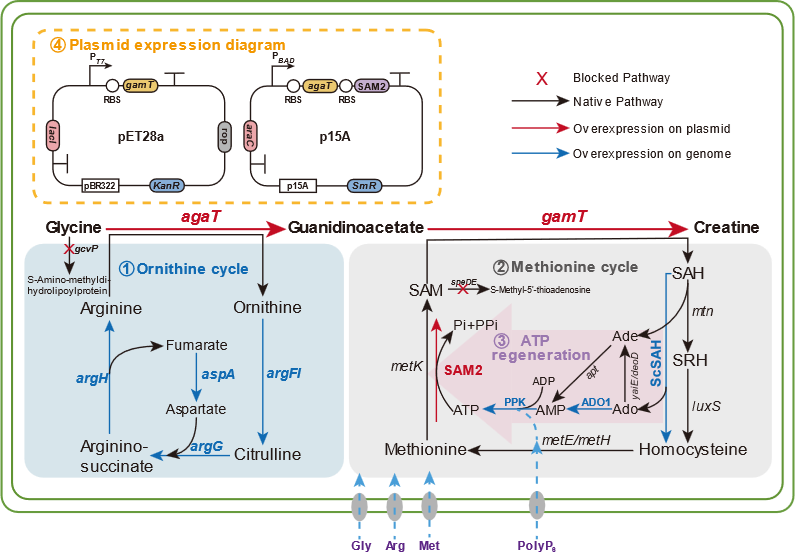
图1 E. coli中CR的合成途径及本研究策略改造图
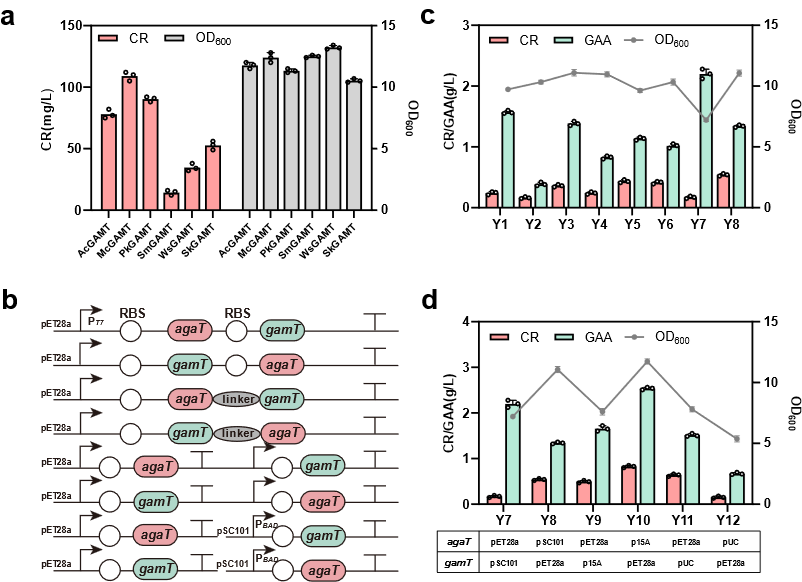
图2 E. coli中CR合成途径的构建
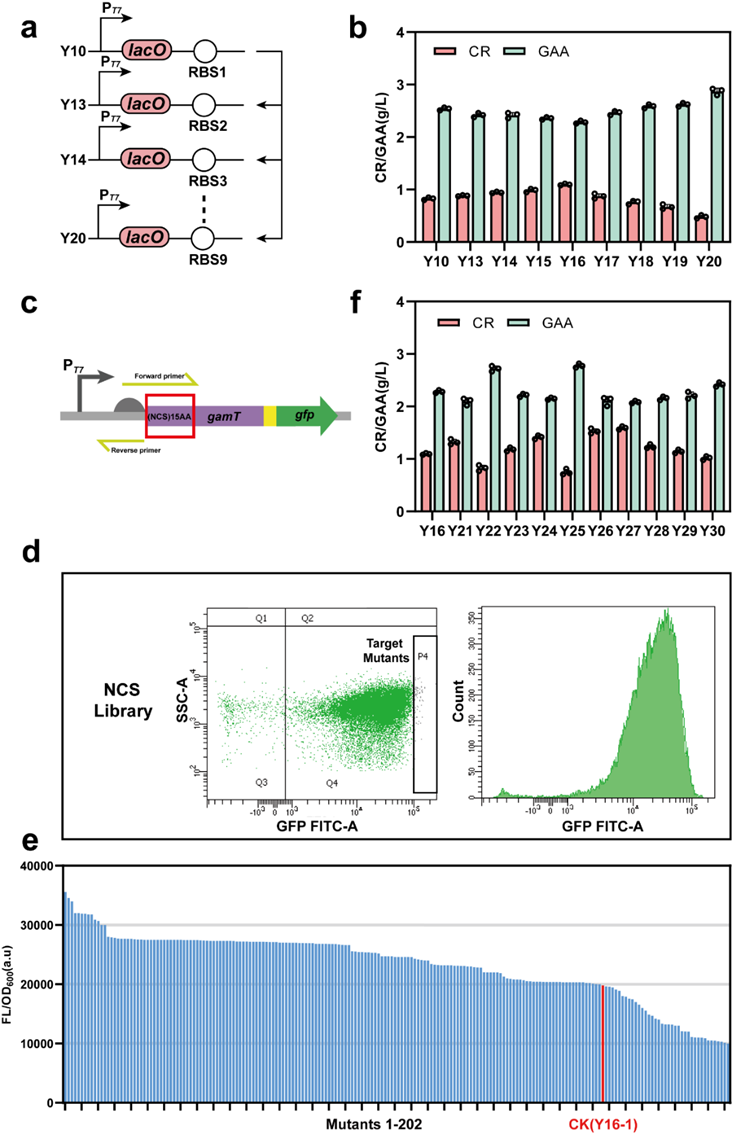
图3 关键限速酶GAMT的表达水平优化
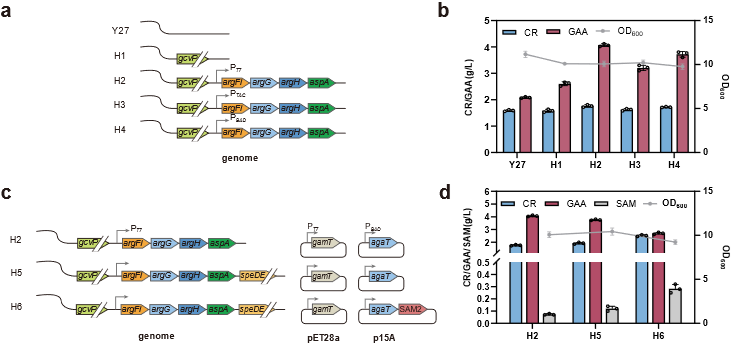
图4 通过强化内源性蛋氨酸和鸟氨酸循环增加胍基乙酸和S-腺苷蛋氨酸的合成
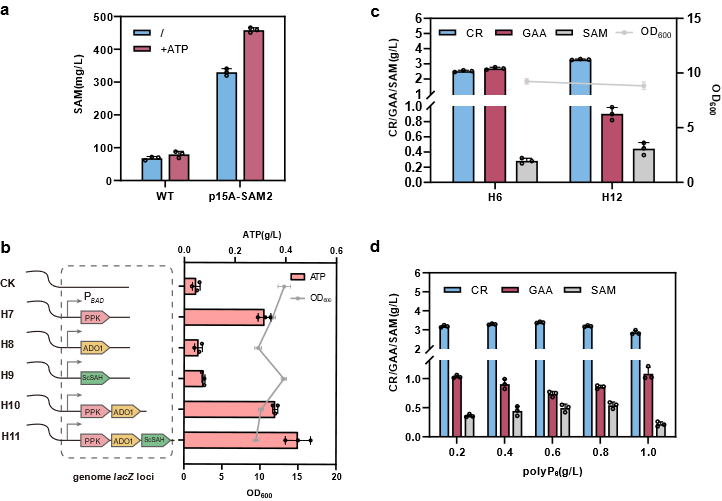
图5 引入基于PPK的ATP再生系统增强甲基供体S-腺苷蛋氨酸的合成
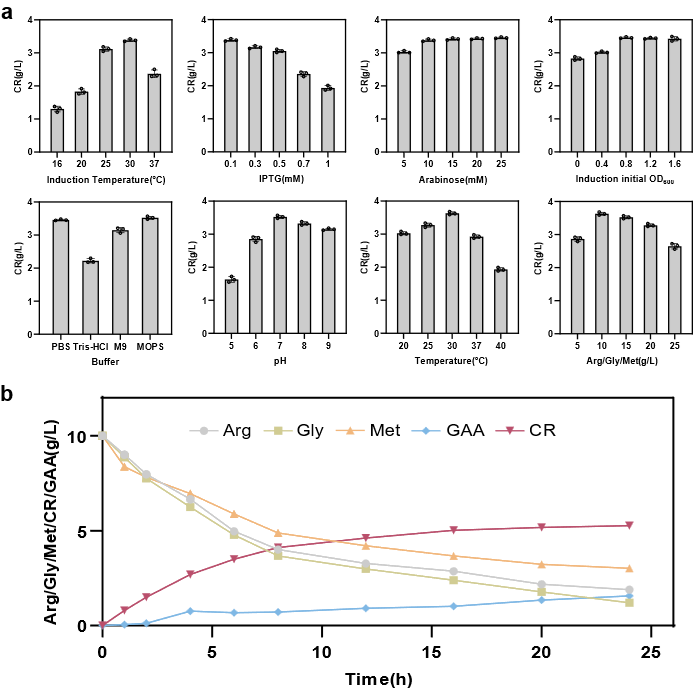
图6 全细胞转化合成CR条件优化及3 L生物反应器的合成测试
