近日,Journal of Agricultural and Food Chemistry发表了江南大学糖化学与生物技术教育部重点实验室刘延峰研究员课题组的研究成果“Biosensor-assisted multi-target gene fine-tuning forN-acetylneuraminic acid production in Escherichia coli with sole carbon source glucose”(Qi, et al., J Agric Food Chem, 2025, 73 (16), 9793-9806)。2022级硕士齐彬为论文第一作者,刘延峰研究员为通讯作者。
N-乙酰神经氨酸(NeuAc)是一种重要的功能糖,具有细胞识别、免疫反应和信号传导等功能,广泛应用于医药、食品等领域,微生物发酵法是目前NeuAc工业化生产的主要方法。大肠杆菌(Escherichia coli)作为典型的模式微生物,是NeuAc生物合成的理想底盘菌株。目前E. coli合成NeuAc已取得显著进展, 但是依旧存在着底物利用效率低、生长与合成失衡等瓶颈。
为解决上述问题,该研究通过重构大肠杆菌底盘细胞、挖掘多基因调控靶点与优化后的生物传感器耦合高通量筛选三阶段代谢工程策略构建了一株高效生产NeuAc的菌株。首先,在出发E. coli菌株的基因组中整合链球菌(Streptococcus mitis)来源的NADH氧化酶(Nox)并敲除中心代谢阻遏因子iclR和arcA以平衡胞内NADH/NAD+,通过整合运动发酵单胞菌(Zymomonas mobilis)来源的葡萄糖转运蛋白Glf替换PTS转运系统,并敲除基因pfkA,使NeuAc摇瓶产量达5.85 g·L-1且无乙酸积累(图1)。随后,通过文献调研与代谢路径分析,选择多个NeuAc合成相关基因并进行单基因或功能模块过表达以扰动胞内代谢流。根据发酵结果选定基因簇glmSA*-glmM-SeglmU作为调控靶点并构建精细化调控文库质粒(图2),并在基因组中整合表皮葡萄球菌(Staphylococcus epidermidis)来源的聚磷酸激酶(SePPK),NeuAc摇瓶产量进一步提升至7.31 g·L-1。最后,通过对带有阻遏因子响应序列的启动子筛选与Bbr_nanR阻遏蛋白的表达强度调整得到优化后的高灵敏NeuAc响应生物传感器(图3),结合生物传感器与流式细胞分选对精细化调控文库质粒进行筛选,经过多轮筛选成功得到NeuAc高产菌株(图4),3-L发酵罐补料分批发酵,以葡萄糖为碳源经过70 h的发酵,NeuAc产量达到58.26g·L-1,生产强度为0.83 g·L-1·h-1,无需添加诱导剂(图5),这为NeuAc的高效合成提供了有效策略。
上述研究工作得到了国家自然科学基金和中央高校基本科研业务费专项资金等项目的资助。
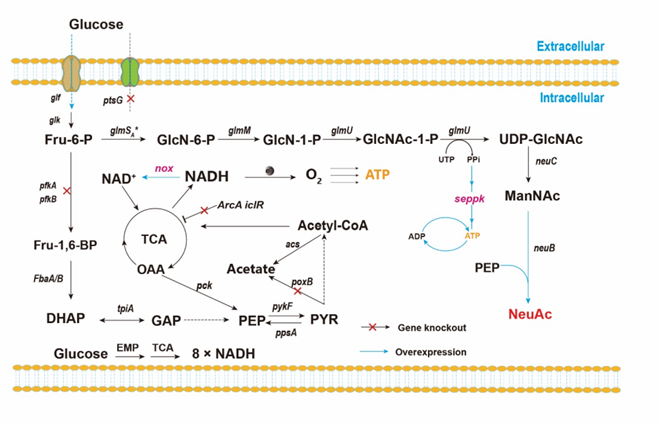
图1 E. coli利用葡萄糖合成NeuAc底盘细胞的构建
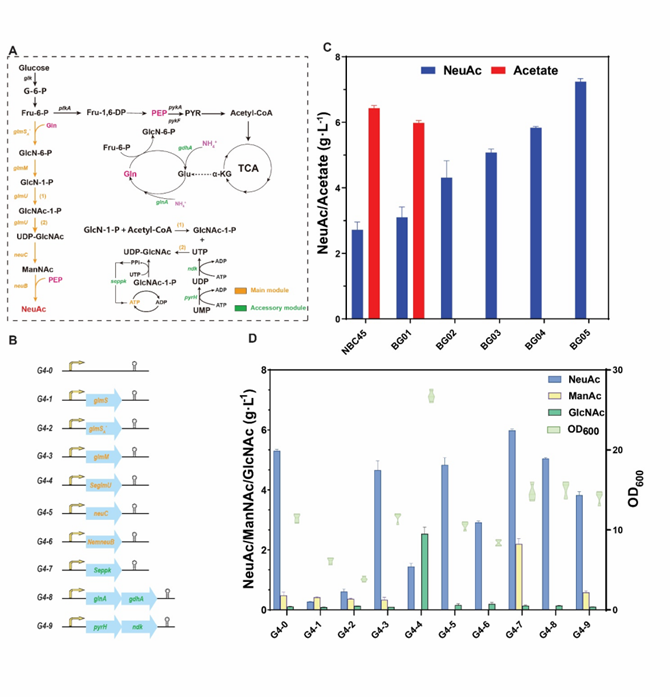
图2 NeuAc合成相关多基因靶点的挖掘
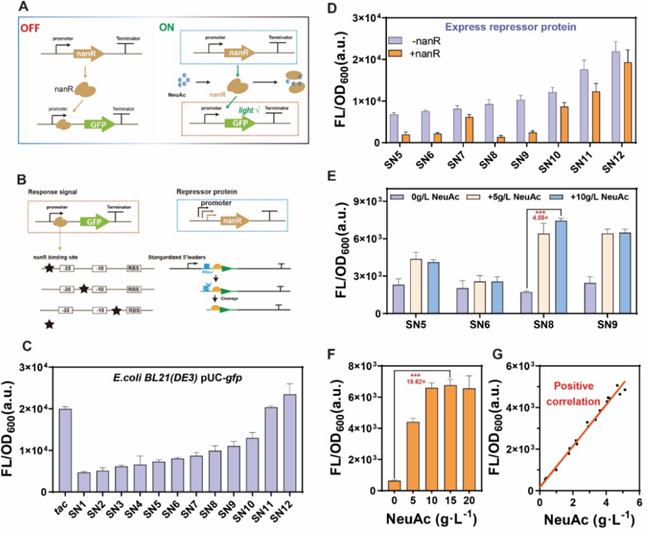
图3 高效响应NeuAc生物传感器的优化过程
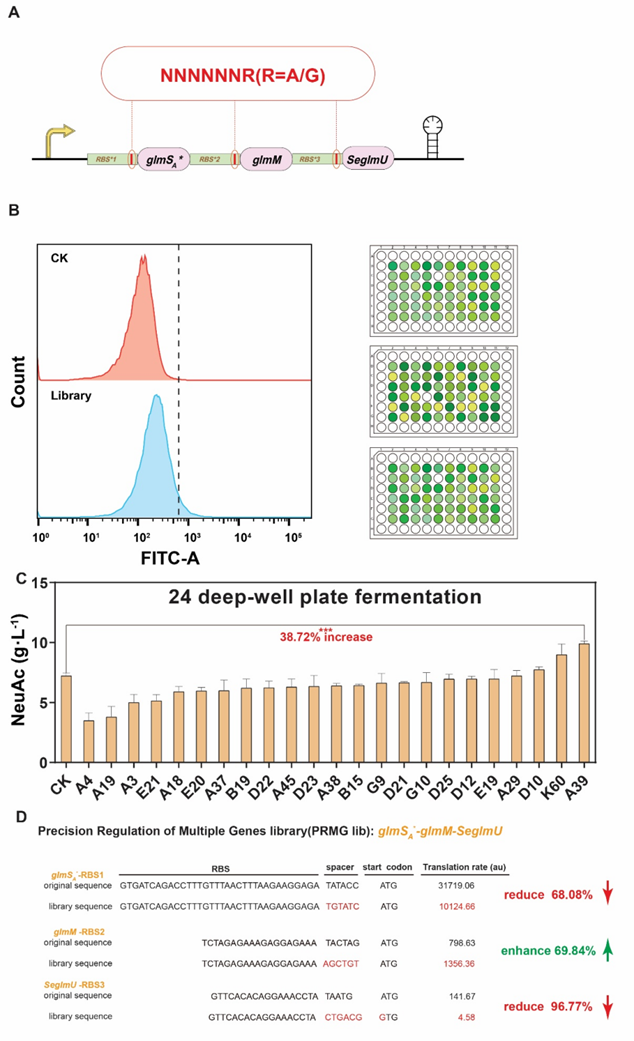
图4 NeuAc高效生产菌株的多轮筛选与表征
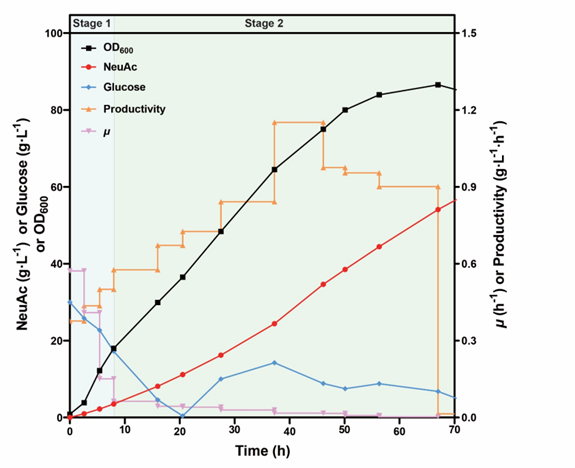
图5 筛选得到的NeuAc高效生产菌株的3-L生物反应器发酵验证
