防晒化合物类菌孢素氨基酸的生物合成
张萍1,2,3,张维娇1,2,3,胥睿睿1,2,3,李江华2,3,陈坚2,3,康振1,2,3
(1江南大学生物工程学院,糖化学与生物技术教育部重点实验室,江苏 无锡 214122;2江南大学未来食品科学中心,江苏 无锡 214122;3江南大学生物工程学院,工业生物技术教育部重点实验室,江苏 无锡 214122)
引用本文: 张萍, 张维娇, 胥睿睿, 李江华, 陈坚, 康振. 防晒化合物类菌孢素氨基酸的生物合成[J]. 合成生物学, 2025, 6(2): 306-319
Citation: ZHANG Ping, ZHANG Weijiao, XU Ruirui, LI Jianghua, CHEN Jian, KANG Zhen. Research advances on the biosynthesis of mycosporine-like amino acids[J]. Synthetic Biology Journal, 2025, 6(2): 306-319
DOI: 10.12211/2096-8280.2024-063

识别查看全文
摘 要
类菌孢素氨基酸(mycosporine-like amino acid,MAA)是一类由水生生物产生的小分子化合物,具有抵御紫外线辐射的功能,近年来作为环保型防晒剂在化妆品领域得到了广泛关注。然而,MAA在生物体中的低积累量、复杂的提取工艺和极低的得率限制了其应用前景。利用合成生物技术,在微生物细胞中重构MAA合成路径,有望实现MAA的规模化生产,为解决MAA供应不足问题提供有效策略。本文系统总结了目前MAA生物合成的研究进展,涵盖了结构多样性分析、生物合成途径解析、底盘细胞构建等方面。重点关注了近期MAA的微生物从头生物合成研究进展,探讨了目前MAA生物合成研究面临的挑战,包括前体含量少、关键酶催化效率低等问题。最后,展望了MAA微生物合成的未来发展方向,如转运蛋白的改造、关键酶的解析等,旨在推动MAA的绿色、高效生物合成。
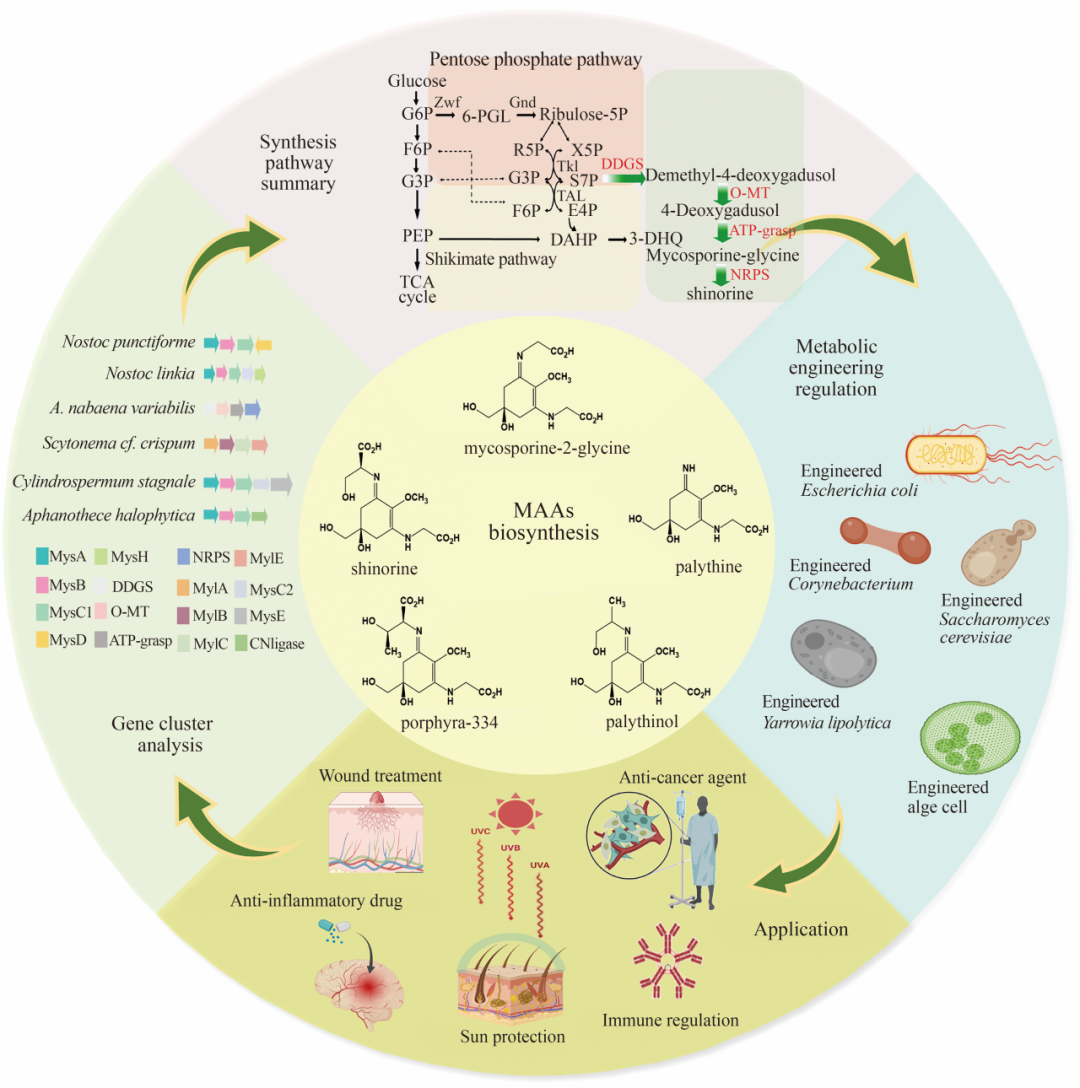
全 文
类菌孢素氨基酸(mycosporine-like amino acid,MAA)是一类水溶性的次级代谢产物,因其卓越的紫外线防护活性,受到广泛的研究关注。MAA的最大吸收波长在268~362 nm,主要集中于309~362 nm,能够有效地吸收UVA和UVB辐射。MAA的分子结构多样,分子量188~1050 Da,其分子结构侧基和氮取代基的不同赋予了其不同的紫外吸收特性。MAA广泛存在于自然界中,尤其是长期暴露于高强度光照环境中的生物体内,如大型海洋藻类(包括绿藻和红藻)、珊瑚等部分海洋无脊椎动物和陆生生物中,MAA的含量尤为丰富。
MAA具有极高的摩尔消光系数[ε=28100~50000 L/(mol·cm)],MAA因其对紫外线防护方面的卓越性能,在防晒霜中的应用已经成为热点。目前,shinorine和porphyra-334已经作为主要活性成分被用于商用防晒品HelioguardTM 365和Helionori。同时,MAA可以清除活性氧(reactive oxygen species,ROS),抑制单线氧诱导的细胞损伤,其中asterina-330的抗氧化性能优于维生素E。此外,shinorine还可以通过激活细胞信号通路FAK-MAPK来加速伤口愈合过程。多项研究表明porphyra-334能够抑制胶原蛋白和弹性蛋白的降解,增加Ⅰ型胶原蛋白的表达水平,降低皮肤炎症水平,有效减缓皮肤衰老。
MAA在抗紫外、抗氧化和抗衰老方面的活性使其在化妆品领域展现出巨大的应用潜力。目前商业化的MAA主要依赖于从藻类中提取,产量极低,仅为0.0045~0.275 mg/g,同时提取过程复杂,导致成本高昂,限制了其在化妆品领域的广泛应用,因此,解决MAA的供应问题对于推动其工业化应用至关重要。合成生物学的快速发展为MAA的合成提供了一种新的解决方案,通过重组工程化微生物合成MAA,有望替代传统的藻类提取方法,突破产量瓶颈,满足化妆品领域对MAA的需求。
1 MAA的结构及性质
1.1 MAA的种类和结构
氨基环己烯酮类MAA有mycosprine-glycine、mycosprine-taurine、mycosprine-ornithine和mycosporine-lysine等,氨基亚胺类MAA包括shinorine、porphyra-334、mycosporine-2-glycine、palythine和palythinol等,还有新型种类mycosporine-4-deoxygadusolyl-ornithine(M-DO)和mycosporine-2-(4-deoxygadusolyl-ornithine)(M-2DO)。
4-deoxygadusol(4DG)是MAA的前体物质。氨基环己烯酮类MAA是4DG与不同的氨基酸发生缩合反应形成(图1)。例如,4DG的C3位的羟基可以被鸟氨酸、赖氨酸、甘氨酸和牛磺酸取代,分别生成单取代MAA:mycosporine-ornithine、mycosporine-lysine、mycosporine-glycine和mycosporine-taurine。氨基亚胺类MAA是mycosporine-glycine C1位的氧原子继续被丝氨酸、甘氨酸、丙氨酸和苏氨酸取代,分别生成不同的二取代MAA:shinorine、mycosporine-2-glycine、palythinol和porphyra-334。研究表明mycosporine-ornithine还可以再结合4DG形成双环鸟氨酸物质即M-DO,M-DO在环的羰基位置继续结合MO,形成终产物M-2DO。不同的MAA结构赋予了其独特的紫外光谱吸收特性,例如,shinorine和porphyra-334的最大吸收波长均为334 nm,而mycosporine-2-glycine和palythine的最大吸收波长分别为331 nm和320 nm。这些独特的光吸收特性使得MAA能保护生物体免受紫外线辐射带来的伤害。
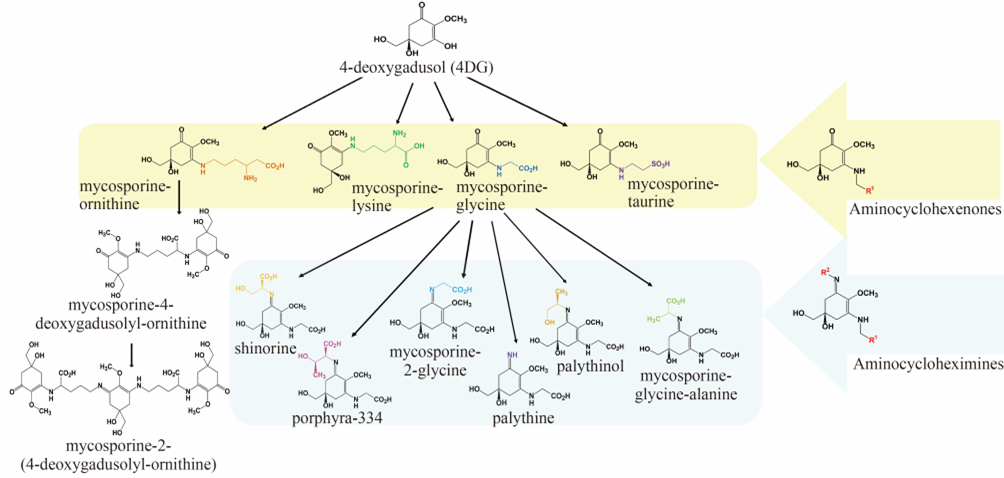
图1 MAA的化学结构
1.2 MAA的生物活性
MAA是天然高效安全的紫外线防护物质,能够有效抵御紫外线辐射带来的损伤。其中40 μmol/L的porphyra-334可以将细胞存活率提高至88%,有效减轻紫外线辐射给细胞带来的损伤。同时,MAA还具有显著的抗氧化活性,能够通过清除自由基,降低炎症反应保护细胞免受氧化损伤。此外,Athukorala等的研究报道,shinorine能够以剂量依赖的方式抑制宫颈癌HeLa细胞和组织淋巴瘤U-937细胞的增殖。此外,MAA可以通过激活JNK和ERK信号通路保护暴露在UVB下的皮肤细胞,并促进受损伤的细胞凋亡。MAA通过抑制ROS和基质金属蛋白酶(MMP)的合成减少结缔组织的降解。Choi等发现shinorine和porphyra-334的复合物可以抑制胶原蛋白和弹性蛋白的降解,同时porphyra-334可以促进胶原蛋白形成,促进成纤维细胞(3T3-L1)增殖,有效维护皮肤健康。MAA还对胚胎和幼虫发育具有保护作用,例如可以对腰鞭毛虫和海胆胚胎具有保护作用,可能与生物的生长有关。
2 MAA的合成途径
2.1 MAA的合成基因簇
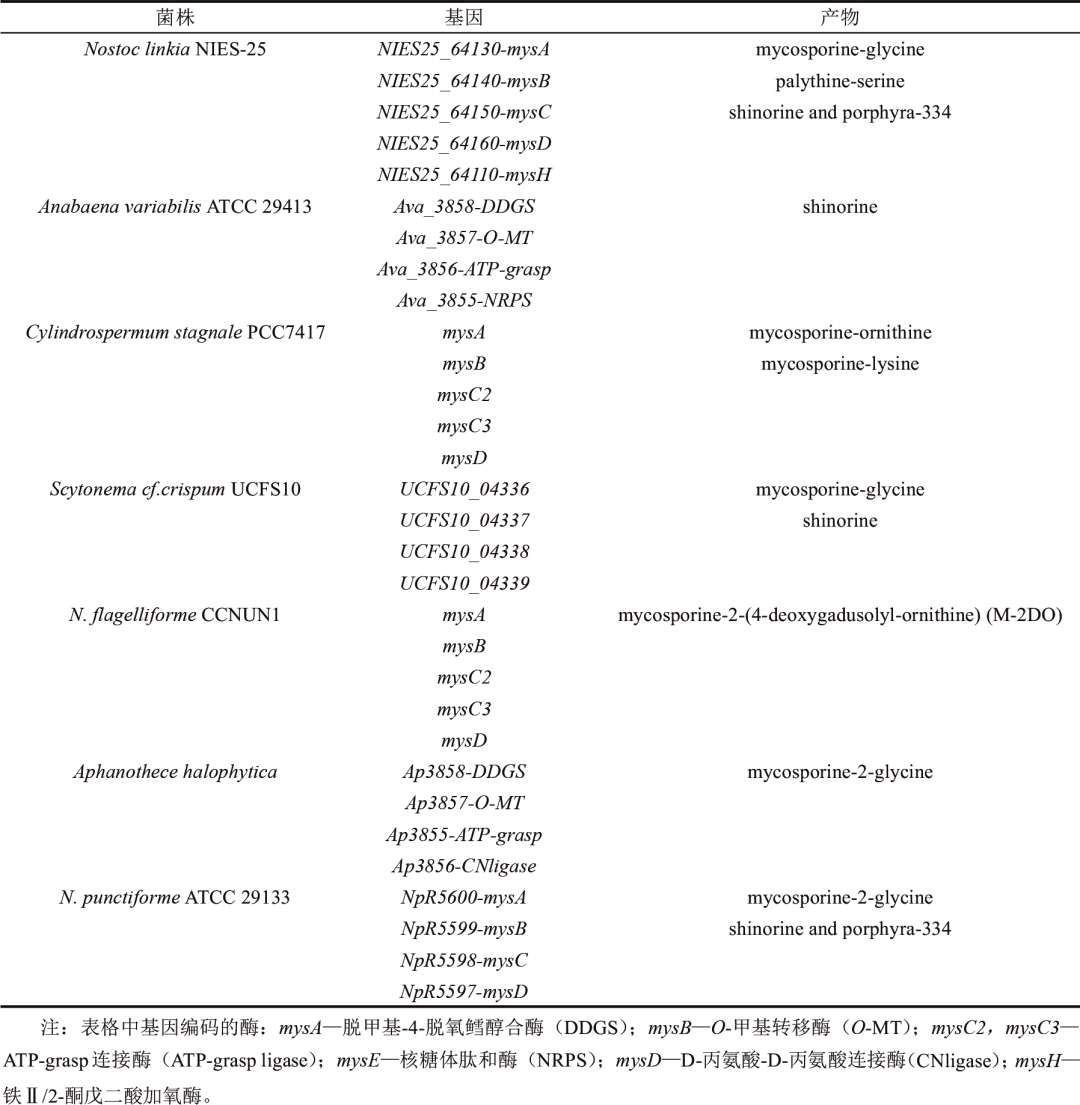
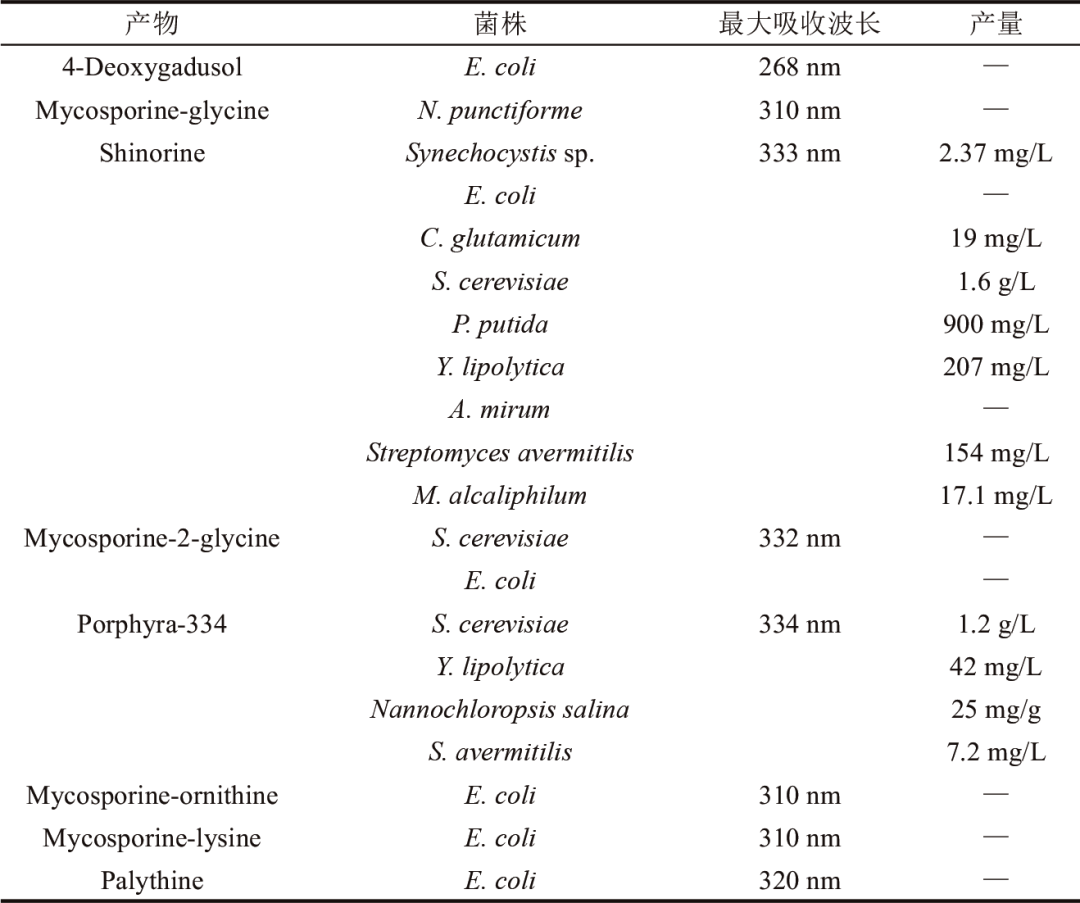
当前MAA基因簇的研究已经有较为全面的报道(表1),MAA的基因簇存在较大的多样性,目前报道的MAA合成基因簇一般来源于蓝藻和放线菌,例如变异鱼腥藻(Anabaena variabilis ATCC 29413)、点形念珠藻(Nostoc punctiforme ATCC 29133)、嗜盐隐杆藻(Aphanothece halophytica)以及奇迹束丝放线菌(Actinosynnema mirum DSM 43827),其中产生的MAA种类主要是shinorine和porphyra-334。编码合成MAA的基因有Ava_3858、Ava_3857、Ava_3856和Ava_3855/mysD,分别编码脱甲基-4-脱氧鳕醇合酶(DDGS)、O-甲基转移酶(O-MT)、ATP-grasp连接酶和D-丙氨酸-D-丙氨酸连接酶(CNligase)。而在Cylindrospermum stagnale PCC 7417和Nostoc flagelliforme CCNUN1的MAA合成基因簇中存在两个ATP-grasp连接酶编码基因(mysC2和mysC3),MysC2催化4DG和鸟氨酸结合生成mycosporine-ornithine,MysC3催化4DG和mycosporine-ornithine形成中间体M-DO。目前已经合成了多种MAA,如shinorine、M-2DO、porphyra-334、mycosporine-2-glycine等。
表1 MAA的生物合成基因簇及主要产物
2.2 MAA的生物合成途径
MAA最早从真菌(Pyronema omphalodes)中分离得到,随后,在海洋藻类和浮游动物体内又陆续鉴定到了MAA。其合成路径引起了研究者们的广泛关注,最初研究者们推测MAA的合成起源于莽草酸途径的中间代谢产物3-脱氢奎尼酸(3-dehydroquinic acid, DHQ),直到2010年Balskus等以莽草酸途径产物DHQ作为底物,加入途径酶脱甲基-4-脱氧鳕醇合酶和O-甲基转移酶进行体外催化反应时,没有检测到中间产物4DG,推翻MAA的合成是通过莽草酸途径的推论。随后,Balskus等又以磷酸戊糖途径产物七磷酸景天庚酮糖(S7P)作为底物,进行体外酶催化反应,成功鉴定到MAA平台化合物4DG,通过体外酶催化实验明确证明,在A. variabilis ATCC 29413和N. punctiforme ATCC 29133中,MAA生物合成的前体是磷酸戊糖途径产物S7P。随着研究者对MAA合成途径的不断探索,Pope等的研究发现敲除A. variabilis中S7P环化酶(2-epi-5-epi-valiolone synthase,EEVS)对于MAA的合成没有影响,推测MAA的合成途径并不局限于磷酸戊糖途径,通过添加莽草酸抑制剂,结合蛋白质组学数据,证明MAA也可经由莽草酸途径合成(图2)。
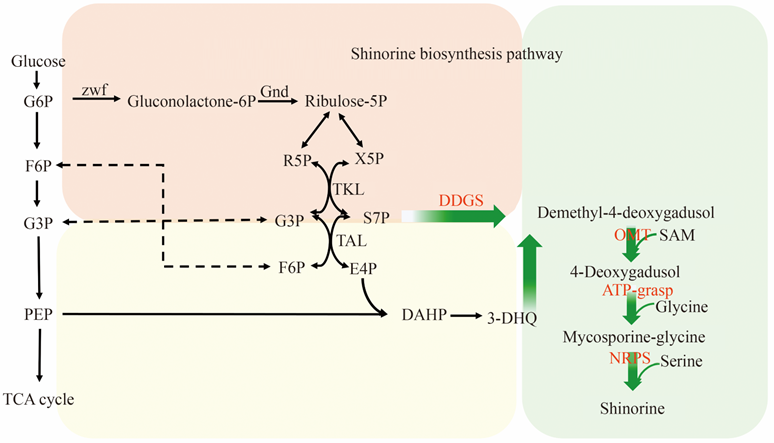
图2 Shinorine的生物合成途径
3 MAA的生物合成研究进展
合成生物学以工程学的设计思维,对生物系统进行定向设计,这一领域的发展有力地弥补了传统有机化学合成在生产结构高度复杂的天然产物时的局限性,促进了生物技术领域的革命性创新,为人类正面临的资源短缺、环境污染等严峻挑战开辟了全新的解决路径。在这一背景下,天然产物是合成生物学研究的核心焦点。目前已经在多种底盘细胞中实现了MAA的生物合成,这些底盘细胞包括Escherichia coli、Corynebacterium glutamicum、Pseudomonas putida、Saccharomyces cerevisiae、Streptomyces avermitilis、Actinosynnema mirum、Methylotuvimicrobium alcaliphilum、Yarrowia lipolytica和Anabaena variabilis等(表2)。
表2 MAAs的生物合成
3.1 大肠杆菌细胞合成MAA
2010年,Balskus等实现了MAA的异源合成,以E. coli作为底盘细胞,异源表达来自蓝藻A. variabilis的MAA合成基因簇,成功检测到产物shinorine。随后,Gao等在E. coli中表达了来自N. punctiforme的MAA合成基因簇,检测到两种产物shinorine和porphyra-334,进一步对其中间产物进行鉴定分析,表达脱甲基-4-脱氧鳕醇合酶、O-甲基转移酶和ATP-grasp连接酶三个途径酶时,能够合成产物mycosporine-glycine,加入非核糖体肽和酶后,能够合成shinorine和porphyra-334。这一结果表明,可能是非核糖体肽和酶对底物选择的偏好性不同的差异,造成MAA种类的多样性。为了进一步解析反应机制,Gao等对非核糖体肽和酶的结构进行了深入研究。发现该酶具有独特的腺苷化结构域,不同于先前报道的非核糖体肽和酶,这为解析MAA的生物合成途径提供了新的视角。随后,Katoch等在Cylindrospermum stagnale PCC 7417中发现了一个新的MAA合成基因簇mylABCDE。在E. coli中异源表达mylABCDE可以合成mycosporine-lysine和mycosporine-ornithine。这一发现拓展了MAA的种类多样性,同时也说明自然界中可能存在着更多未知的MAA合成途径。
2021年Chen等利用生物信息学方法,从念珠藻N. linckia NIES-25中挖掘并鉴定出一个新的MAA合成基因簇mysABCDH,该基因簇编码四种酶,其中mysH编码的D-丙氨酸-D-丙氨酸连接酶被鉴定为一种新型的途径酶。D-丙氨酸-D-丙氨酸连接酶具有广泛的底物谱,能够利用丝氨酸(serine)、苏氨酸(threonine)、丙氨酸(alanine)、半胱氨酸(cysteine)、精氨酸(arginine)和甘氨酸(glycine)等6种氨基酸作为底物,催化mycosporine-glycine和氨基酸的结合,生成6种新的MAA产物:mycosporine-glycine-serine,mycosporine-glycine-threonine,mycosporine-glycine-alanine,mycosporine-glycine-cysteine,mycosporine-glycine-arginase和mycosporine-2-glycine。这一发现拓展了更多种类的氨基酸参与到MAA的合成,为开发新型防晒剂提供了新的可能性(表2)。同时也发现D-丙氨酸-D-丙氨酸连接酶对不同底物氨基酸的选择性偏好差异。其中,D-丙氨酸-D-丙氨酸连接酶偏好与底物苏氨酸相结合,能够高效地将大部分中间体mycosporine-glycine转化为mycosporine-glycine与苏氨酸相结合的产物porphyra-334,为提高porphyra-334产量提供了重要的研究思路。
Zhang等的研究报道了一种结构复杂的新型MAA,在E. coli中表达了来自N. flagelliforme CCNUN1的五个参与MAA合成途径基因——mysA、mysB、mysC2、mysC3和mysD,其中mysC2和mysC3都编码ATP连接酶。该研究报道了MAA合成过程的多步反应过程:首先,脱甲基-4-脱氧鳕醇合酶和O-甲基转移酶催化底物S7P合成了前体物质4DG;随后ATP-grasp连接酶与前体4DG结合生成mycosporine-ornithine;接着mycosporine-ornithine在ATP-grasp连接酶作用下结合4DG,合成双环鸟氨酸物质M-DO;最后D-丙氨酸-D-丙氨酸连接酶继续催化M-DO与mycosporine-ornithine结合,合成终产物M-2DO。来自N. flagelliforme CCNUN1的MAA合成基因簇展示了一种与之前已知MAA合成方式不同的机制。这可能是由于该途径中存在两个功能不同的ATP连接酶所导致的,尽管同属于ATP家族酶,但它们在合成过程中对底物的选择和合成机制有所不同。这项研究表明,同源但功能不同的ATP连接酶为合成更多MAA种类提供了新的思路。
3.2 谷氨酸棒杆菌细胞合成MAA
Corynebacterium glutamicum常用于氨基酸发酵,而氨基酸在MAA的合成过程中占据至关重要的位置。2018年,Tsuge等以Corynebacterium glutamicum作为底盘细胞,实现了MAA的生物合成。首先改造MAA合成起始物质S7P的合成途径,S7P主要通过磷酸戊糖途径合成,通过提高磷酸戊糖途径关键限速酶6-磷酸葡萄糖酸脱氢酶(G6PDH)的表达量,使更多碳通量流向磷酸戊糖途径,同时为了减少S7P的消耗,进一步敲除Corynebacterium glutamicum中S7P的下游消耗酶转醛酶(transaldolase,TAL),通过对G6PDH基因的过表达和对TAL基因的敲除,最终在Corynebacterium glutamicum中将shinorine的产量提高了60%,达到19 mg/L,为shinorine的工业化生产奠定了重要基础。
3.3 恶臭假单胞菌细胞合成MAA
在最近的研究中,Yunus等通过基因组规模代谢模型(GEM)的预测,筛选出适合shinorine生产的宿主Pseudomonas putida KT2440,其后开发了在P. putida使用的基因编辑元件,并进行了遗传元件的表征,可以在P. putida中实现多片段DNA组装,结合碳代谢流分析和Shotgun蛋白质组学技术识别了其前体S7P潜在的竞争途径,利用CRISPRi基因编辑元件对其竞争途径的21个潜在基因进行下调,在下调基因PP_1444后,shinorine的滴度得到了显著提升。此外,通过代谢组学分析发现,下调PP_1444的表达可以提高甘氨酸和丝氨酸的合成,进而有利于shinorine的合成。随后,通过设计、优化启动子和改变核糖体结合位点(ribosome binding site,RBS)强度,构建21个不同强度的表达质粒,调节shinorine合成途径相关蛋白表达水平,发酵72 h后,shinorine的产量从100 mg/L提升到467 mg/L。在此基础上,继续优化培养基配方,在发酵培养基中外源补充甘氨酸和丝氨酸,最终shinorine的产量达到900 mg/L。
Yunus等的研究结果显示下调PP_1444后,提高了胞内甘氨酸和丝氨酸的含量,显著提升shinorine的产量。基因PP_1444在P. putida中编码葡萄糖脱氢酶,参与了磷酸戊糖途径中葡萄糖的磷酸化,在磷酸戊糖途径中占据重要位置。该研究结果显示下调PP_1444后,导致胞内前体S7P含量降低,却能够提升shinorine的产量,提示可能胞内甘氨酸和丝氨酸含量的提升拉动了S7P流向产物shinorine的合成。该研究为shinorine的生物合成提供了新的思路,但全面阐明驱动shinorine合成的潜在机制仍然需要进一步的研究。
3.4 酵母底盘细胞合成MAA
2019年,Park等以Saccharomyces cerevisiae为表达宿主,基因组整合了来自N. punctiforme的MAA合成基因簇,合成产物shinorine。为了增强前体物质S7P,引入木糖利用途径,表达来自Scheffersomyces stiptis的木糖同化基因xyl1(xylose reductase)、xyl2(xylitol dehydrogenase)和xyl3(xylulokinase),同时强化磷酸戊糖途径基因TKL1。为了进一步增加S7P的含量,敲除S7P的下游消耗基因TAL,shinorine产量提升至18 mg/L。同时优化培养基碳源比例,在含有12 g/L葡萄糖和8 g/L木糖的培养基中进行发酵培养,最终shinorine产量达到了31 mg/L。该项研究为在Saccharomyces cerevisiae中合成shinorine奠定了基础。
随后,Jin等为了缩短前体S7P的利用途径,引入木糖利用途径。由于Saccharomyces cerevisiae对木糖的利用能力有限,敲除己糖激酶,降低了葡萄糖的分解代谢,提高木糖利用率,将碳通量从糖酵解途径转向磷酸戊糖途径。同时,过表达来自A. variabilis的脱甲基-4-脱氧鳕醇合酶,优化发酵条件,最终在14 g/L葡萄糖和6 g/L木糖培养基中shinorine产量达到68.4 mg/L,进一步提升了Saccharomyces cerevisiae合成shinorine的能力,也证实了Saccharomyces cerevisiae作为MAA生产宿主的潜力。
在此基础上,Kim等以Saccharomyces cerevisiae作为表达宿主将木糖利用途径基因整合入Saccharomyces cerevisiae基因组中,敲除卤酸脱卤酶ⅡA型磷酸功能酶基因(PHO13),据报道该基因的缺失会导致磷酸戊糖途径的上调,促进Saccharomyces cerevisiae对木糖的利用效率。结果显示敲除PHO13后,菌株对木糖的利用效率得到显著提升,在18 h内细胞干重(DCW)达到了9.2 g/L,更多的碳通量流向了糖酵解途径,而产物shinorine产量并没有增加,导致菌体只快速生长而没有目标产物生成。为了解决这个问题,进一步敲除S7P的下游消耗途径基因TAL,最后在5 L生物反应器中进行发酵培养,shinorine产量达到751 mg/L。
随即,Jin等以Y. lipolytica作为表达宿主,将来自A. variabilis和N. punctiforme的MAA合成途径酶进行基因组整合表达,通过强化启动子、增加途径基因拷贝数、增强磷酸戊糖途径通量以及优化培养基碳源比例等一系列策略,显著提升了MAA的产量。最终,在含有10 g/L葡萄糖和10 g/L木糖的培养基中,实现了249 mg/L的MAA总产量,其中shinorine为207 mg/L,porphyra-334为42 mg/L。虽然目前Y. lipolytica生产MAA的产量尚低于Saccharomyces cerevisiae,但其巨大的提升空间预示着其作为MAA合成平台的巨大潜力,为未来开发高效、可持续的MAA生产方法开辟了新的方向。
Kim等在之前的研究基础上,对Saccharomyces cerevisiae进行了更深入的改造。首先通过强化磷酸戊糖途径,将更多碳通量引向MAA的合成途径,接着引入木糖利用途径,进一步增加前体物质S7P的含量,随后敲除S7P下游消耗途径基因TAL,促进S7P的积累,同时引入mycosporine-glycine的合成途径基因,获得mycosporine-glycine的高产菌株。继续整合5个不同来源的D-丙氨酸-D-丙氨酸连接酶途径酶,并对其进行底物偏好性分析,发现Lyngbya sp.、Nostoc linkia.和Euhalothece sp.来源的D-丙氨酸-D-丙氨酸连接酶分别对丝氨酸、苏氨酸和甘氨酸具有高度特异性,分别催化生成shinorine、porphyra-334和mycosporine-2-glycine。最后在5 L生物反应器中发酵培养,产生1.5 g/L的shinorine和1.2 g/L的porphyra-334。这是迄今为止报道的最高滴度。Kim等的研究实现了Saccharomyces cerevisiae对木糖的利用,但是利用率较低,可进一步对Saccharomyces cerevisiae中的糖转运系统优化改造,提高其对木糖的利用率,进而促进MAA的生物合成。
Hengardi等的研究报道了一种新的策略来增加Saccharomyces cerevisiae中shinorine的产量,通过敲除前体S7P下游消耗基因TAL,同时对糖酵解途径的关键酶磷酸果糖激酶(phosphofructokinase 2,PFK2)基因进行敲除,将使得代谢通量从F6P转向PPP途径,提高了Saccharomyces cerevisiae中S7P和shinorine的产量,最终shinorine在Saccharomyces cerevisiae中的含量较原始菌株提高了9倍。
3.5 藻类底盘细胞合成MAA
Yang等在蓝藻中实现了MAA的合成,对四种蓝藻(Anabaena variabilis PCC 7937、Anabaena sp. PCC 7120、Synechocystis sp. PCC 6803和Synechococcus sp. PCC 6301)的发酵产物进行了鉴定分析,发现只有A. variabilis具有合成MAA的潜力。通过基因组测序分析,发现脱甲基-4-脱氧鳕醇合酶和O-甲基转移酶在A. variabilis中是特有的,在其他三株蓝藻中缺失。通过这一发现揭示了参与MAA合成的关键基因,为后续在其他藻类中生物合成MAA奠定了基础。
在此基础上,Singh等实现了在Synechocystis sp. PCC6803中生物合成MAA,通过表达来自Fischerella sp. PCC 9339的shinorine合成基因簇(FsA-D),初步合成shinorine。然后采用不同强度的启动子(PrnpB、Ptrc和Pcpc)调控途径酶的转录强度,发现使用强启动子Pcpc作为表达元件时,shinorine的产量达到2 mg/g。结果表明Synechocystis sp.可以作为生产MAA的有效宿主,进一步扩展了MAA生产的可能性。
随后,Shang等在N. flagelliforme中鉴定出新的MAA合成基因簇mysA-mysB-mysC2-mysC1-mysD,并挖掘到LuxR家族蛋白OrrA可以作为该基因簇的转录因子,响应UVB的照射。通过过表达orrA,增强了菌株对UVB的耐受性,保护N. flagelliforme免受紫外线的伤害。此外,继续在Anabaena sp. PCC 7120中异源表达该基因簇mysA~D,鉴定出新的MAA种类M-2-DO。该研究揭示了一个新的MAA生物合成途径,为蓝藻高效生产新型MAA建立了基础。
以微绿球藻Nannochloropsis salina CCMP 1776作为表达细胞,表达来自P. yezoensis的MAA的合成基因簇,光照培养7天,MAA总产量达到28.3 mg/g,其中主要成分porphyra-334的产量为25 mg/g。同时研究表明,在N. salinaz细胞中合成的porphyra-334展现出强大的抗紫外线和抗氧化性能,有效保护细胞免受紫外线照射导致的生长受阻和有效降低活性氧水平。藻类细胞由于具有生长速度快、安全性高以及完善的遗传工具等优点,因此是大量合成MAA的优势宿主。
3.6 链霉菌底盘细胞合成MAA
链霉菌因其能够合成种类繁多的次级代谢产物而受到广泛关注,Miyamoto等以Streptomyces avermitilis SUKA22为底盘菌株,表达了来自Actinosynnema mirum DSM 43827的MAA合成基因簇,成功检测到了产物shinorine、porphyra-334和一种新型MAA。通过质谱和核磁共振表征,证实该新型MAA为mycosporine-glycine-alanine。其发酵培养后产量达到188 mg/L,其中主要产物shinorine的产量为154 mg/L,porphyra-334的产量为7.2 mg/L。此外,作者单独培养放线菌并对其MAA进行提取和测定,通过对比在链霉菌中异源表达和放线菌中提取的MAA含量,研究发现,Streptomyces avermitilis中异源表达的MAA产量是放线菌中的MAA产量的400倍。这一结果展示了链霉菌作为MAA异源表达平台的高效性,也为未来MAA的异源合成提供了重要参考。
3.7 甲基营养菌底盘细胞合成MAA
甲基营养菌同样具有合成shinorine的能力,Nguyen等将shinorine合成途径基因转入M. alcaliphilum 20Z菌株,为了增加关键前体S7P的合成,利用强启动子Ptac对磷酸物戊糖途径非氧化支路关键酶转酮醇酶(TKT1)基因进行强化表达,使得更多碳通量流向前体S7P的合成。为了进一步提高S7P的含量,研究人员将木糖利用途径关键基因xylA、xylB和rpe整合到M. alcaliphilum 20Z基因组中,随后利用木糖和甲烷作为混合碳源进行发酵培养,然而产生大量副产物甲酸。为了减少副产物甲酸积累,作者在培养基中添加了5 μmol/L钨,显著促进了甲酸的氧化,提高木糖的消耗率和菌株的生长速度。通过对M. alcaliphilum 20Z的代谢工程改造和培养条件优化,最终在M. alcaliphilum 20Z中合成17.13 mg/L shinorine。
挑战与展望
MAA作为一种天然、高效且安全的防晒物质,具有广阔的应用前景,由于其分离困难、产量极低且成本高昂,目前商用防晒产品中的shinorine和porphyra-334,均是从藻类中提取获得。虽然关于MAA的合成生物学研究已有报道,但这些研究仍局限于实验室阶段,且尚未进入中试放大阶段。当前MAA的生物合成产量低是制约其工业化应用的关键瓶颈,远远不能满足化妆品行业对原料的高需求。未来,为了实现MAA的规模化生产,还需要在多个方面进行技术改进和深入探索。
目前,MAA通常积累在细胞质中,而MAA与低聚糖共价结合后形成的复合物可以在胶鞘中检测得到,推测可能是MAA经过某种糖基化修饰后,可以实现从胞内转运到胞外,暗示MAA具有从细胞内向细胞外的运输过程。MAA及时有效地转运至胞外可以降低胞内产物浓度,避免浓度过高对细胞造成毒性和引起反馈抑制,使细胞工厂对产物MAA具有较强的耐受性,有利于MAA产物最大化生产。因此,未来关于MAA转运机制的研究仍具有广阔的探索空间。例如,可以利用基因组学和蛋白质组学技术,筛选和鉴定与MAA跨膜转运相关的转运蛋白。通过比对已知转运蛋白家族的序列,可以预测潜在的转运蛋白候选基因。此外,利用人工智能技术挖掘MAA的转运蛋白元件,设计更高效、稳定的转运系统,实现对MAA转运的更好控制。通过人工智能进行转运蛋白的设计,借鉴已知转运蛋白的结构域和功能基团,构建便于遗传操作的精简型转运蛋白,从而实现将胞内产物MAA有效转运至胞外,并更好地实现物质的分离与纯化。
MAA的研究主要集中在解析和重组不同的基因簇,以及调控其代谢途径。尽管在基因簇解析、异源表达和途径调控方面取得了一些进展,但对合成途径中关键酶的深入解析和改造仍处于初步阶段。2010年,Balskus等的研究指出,脱甲基-4-脱氧鳕醇合酶是MAA合成途径中的关键酶,其催化的S7P环化反应是该途径的关键限速步骤。改造限速步骤的关键酶被认为是提高产物产量的有效策略。近年来,基于蛋白结构模拟、分子对接和虚拟突变技术已成为酶改造领域常用方法。例如,Xu等通过改造磺基转移酶负责结合APS的3′-PB序列,成功筛选了一系列活性提高的突变体,不仅实现了对底物的高选择性修饰,而且提高了体系催化效率。类似地,对于MAA生物合成限速酶脱甲基-4-脱氧鳕醇合酶的改造,可以根据其三维结构或序列比对,寻找改造的潜在靶点。利用快速基因编辑方法构建突变体文库,并通过HPLC/MS进行筛选确认,获得高活力突变体,从而有效提高途径酶的催化效率。
异源表达MAA的宿主主要包括E. coli、Corynebacterium glutamicum、P. putida、S. cerevisiae、Y. lipolytica和A. variabilis等。每种宿主系统都有其独特的优势和面临的挑战。例如,E. coli和Corynebacterium glutamicum作为原核宿主,它们的基因编辑操作简便、生长速度快,但是这两种系统存在的问题是宿主菌体的生物量相对较低和MAA的产量有限,在一定程度上限制商业化生产MAA的应用潜力。相比之下,A. variabilis作为MAA的天然生产宿主,理论上可以高效合成表达MAA,但是由于存在培养周期长、对环境条件要求高以及产量仍然较低等问题,制约了其应用。在这种背景下,Saccharomyces cerevisiae作为一种真核宿主表达系统,凭借其具有的多种优势,如易于基因操作、生长周期短以及较高的表达效率等,逐渐成为研究焦点。尤其是Kim等的研究,利用Saccharomyces cerevisiae作为底盘细胞构建了一系列MAA的表达系统,实现目前最高MAA产量为1.2 g/L。这一成果不仅展示了S. cerevisiae在合成MAA方面的巨大潜力,也为进一步提高MAA的产量和降低生产成本提供了重要的参考。
通讯作者及团队介绍

康振,教授,博士生导师,国家级青年人才计划入选者。主持包括国家重点研发课题、国家自然科学基金、江苏省科技支撑等在内的省部级纵向项目,研究方向为微生物合成生物学与生物制造研究。近年在Nature Communications、ACS Catalysis、Green Chemistry、Metabolic Engineering等主流杂志发表研究论文102篇,出版专著(或教材)5部;授权中国发明专利79件,美国发明专利4件;转让透明质酸酶、低分子量透明质酸、硫酸软骨素等12项生物制造技术。获教育部科技进步一等奖(1/12)、山东省科技进步一等奖(2/12)、中国轻工业联合会技术发明二等奖(1/6)等。
