
Trends in Food Science & Technology| 乳源生物活性蛋白的微生物细胞工厂构建:结构 - 功能表征、底盘细胞筛选及全流程表达调控
近日,重点实验室吕雪芹研究员和刘龙教授及其团队在《Trends in Food Science & Technology》期刊上发表了题为《Engineering microbial cell factories for milk-derived bioactive proteins: Structural-functional profiling, chassis selection, and full-pipeline expression control》的综述论文(一区,15.4)。该研究系统梳理了乳源生物活性蛋白(MDBPs)的结构功能特征,构建了微生物细胞工厂(MCFs)全流程生产框架,包括 GRAS/QPS 认证底盘细胞筛选、转录翻译优化、翻译后修饰(磷酸化、糖基化)重构、分泌通路工程及蛋白稳定性调控。研究揭示,精准复刻天然翻译后修饰与提升分泌通路通量是保障 MDBPs 生物活性与产量的核心,AI 辅助的设计 - 构建 - 测试 - 学习(DBTL)闭环可加速工艺优化。这一发现为功能食品、临床营养领域所需乳源生物活性蛋白的可持续、规模化生产提供了关键技术支撑。
Background
全球人口预计在 2050 年达到 97 亿,蛋白质需求较 2021 年将增长 23%,传统蛋白质供应已难以满足日益扩大的供需缺口。植物蛋白和培养肉等替代蛋白虽能缓解资源压力、满足基础营养需求,但缺乏乳源生物活性蛋白(MDBPs)所特有的生理功能 —— 这类蛋白质广泛存在于牛乳和人乳中,分为酪蛋白和乳清蛋白两大类,还包括骨桥蛋白(OPN)、免疫球蛋白(Ig)、溶菌酶等功能成分,在免疫调节、神经发育、矿物质稳态维持等方面发挥不可替代的作用,部分成分还具有疾病预防和抗癌潜力,是精准营养和功能食品设计的核心分子基础。
目前 MDBPs 的工业化生产主要依赖从天然乳源中提取,通过膜分离、色谱纯化、沉淀等工艺实现,但这类方法存在显著局限:原料供应受季节影响且总量有限,分离效率偏低导致生产成本高昂,纯化过程中还易发生蛋白质结构与功能降解,难以满足全球对低成本、规模化 MDBPs 的需求。
合成生物学驱动的微生物细胞工厂(MCFs)为 MDBPs 生产提供了可持续替代方案,通过酿酒酵母、大肠杆菌等模式微生物作为底盘,可实现精准可控的发酵生产,规避传统畜牧业带来的环境与伦理问题。但 MCFs 的应用仍面临多重瓶颈:复杂 MDBPs 的翻译后修饰(磷酸化、糖基化等)难以精准复刻,分泌通路效率有限,蛋白质折叠与稳定性调控不足,且现有研究多聚焦单一表达元件优化,缺乏对底盘选择、功能保留与多调控节点协同作用的整合考量。
因此,针对 MDBPs 的独特结构功能特征,构建涵盖底盘筛选、转录翻译优化、PTMs 重构、分泌调控及蛋白稳定性保障的全流程整合框架,解决传统生产局限与 MCFs 技术瓶颈,成为推动 MDBPs 工业化、满足精准营养与功能食品需求的迫切需求,这也是本研究开展的核心背景。
Results
MDBPs 的结构功能特征与可生产性关联
乳源生物活性蛋白(MDBPs)分为酪蛋白、乳清蛋白、酶类及微量功能蛋白,结构功能差异显著且决定其微生物可生产性。酪蛋白依赖磷酸化簇和胶束形成能力,乳清蛋白中乳铁蛋白(LF)、骨桥蛋白(OPN)需复杂糖基化与二硫键配对,这类高结构复杂度 MDBPs 需糖工程酵母或丝状真菌底盘;而 α- 乳清蛋白(α-LA)、β- 乳球蛋白(β-LG)等结构简单、翻译后修饰(PTMs)需求低的 MDBPs,可通过工程大肠杆菌或 GRAS 酵母高效表达。MDBPs 的生理功能依赖特定结构,如酪蛋白的磷酸化介导钙结合与胶束组装,κ- 酪蛋白的糖基化增强胶体稳定性,LF 的铁结合结构赋予抗菌与肠道屏障修复活性,这些结构需在微生物表达中精准复刻。
微生物底盘细胞的选择与优化策略
微生物底盘分为生产底盘与工具底盘,选择需匹配 MDBPs 结构特性。生产底盘(如枯草芽孢杆菌、酿酒酵母、米曲霉)具备 GRAS/QPS 认证,枯草芽孢杆菌可利用木糖作为食品级诱导剂,分泌效率高;酿酒酵母能提供基础 PTMs 但存在高甘露糖基化问题,需进一步工程改造。工具底盘(大肠杆菌、毕赤酵母)遗传可操作性强、表达效率高,适用于早期研发,大肠杆菌适合简单结构 MDBPs 表达,毕赤酵母可支持复杂 MDBPs 的折叠与部分 PTMs。双宿主策略可兼顾研发灵活性与产业化合规性,早期用工具底盘优化表达元件,后期转入生产底盘实现食品级生产,但需解决底盘间转录调控、信号肽识别等差异导致的表达模块适配问题。
MDBP 表达系统的全流程优化
转录与翻译优化需协同适配底盘特性,毕赤酵母中乙醇诱导型启动子可替代甲醇诱导型 AOX1 启动子,兼顾安全性与表达强度,使 β-LG 产量达 0.6 g/L;密码子 harmonization 结合优化 Kozak 序列与转录稳定基序,能提升核糖体招募与 mRNA 稳定性。内质网(ER)折叠网络工程可缓解蛋白错误折叠,调控 HAC1 通路或共表达分子伴侣,能使血清白蛋白(SA)产量提升 15.3 倍;通过微调翻译速率、增强氧化还原稳态,可减少二硫键错配与聚集。 trafficking 与分泌优化聚焦信号肽工程,α- 交配因子(α-MF)与内源性信号肽的杂合设计,可使 LF 在毕赤酵母中表达量提升 200 倍;过表达 SEC16、SAR1 等囊泡运输调控因子,或删除非必需内源性分泌蛋白基因,能缓解分泌通路竞争,提升胞外产量。
翻译后修饰与蛋白稳定性的调控
精准复刻 PTMs 是保障 MDBPs 生物活性的核心,通过在大肠杆菌中引入工程激酶电路,可实现 αs1 - 酪蛋白的位点特异性磷酸化与功能激活;对毕赤酵母进行多基因编辑(敲除 OCH1 基因、异源表达哺乳动物糖基转移酶),能重构人源化 N - 糖基化通路,改善 LF 等糖蛋白的免疫相容性与活性。蛋白稳定性需针对性防护,敲除毕赤酵母蛋白酶基因 PEP4 和 YPS1,可使 HSA/PTH 融合蛋白完整率从 30% 提升至 80% 以上;对 LF 等含柔性结构域的 MDBPs,可通过序列工程删除氧化敏感残基或融合溶解性增强标签,抑制聚集与降解;下游加工中需控制细胞裂解与处理条件,避免额外蛋白酶暴露导致的降解。
AI 辅助 DBTL 循环的优化价值与应用前景
AI 辅助的设计 - 构建 - 测试 - 学习(DBTL)闭环是 MDBP 产业化的关键方向。设计阶段通过 AI 重构启动子、信号肽等模块,优化 5' 非翻译区(5'-UTR)可提升 α-LA 翻译效率;构建测试阶段结合核糖体图谱(Ribo-seq)、糖组学等技术,能精准定位翻译瓶颈与糖基化异质性问题。学习阶段整合多组学数据与基因组尺度代谢模型,构建 “数字底盘”,可量化干预效果、优先优化路径,降低规模化风险。未来丝状真菌(里氏木霉、黑曲霉)凭借更强的分泌通量,有望成为下一代底盘;同时需整合 GRAS/QPS 认证、过敏原评估等监管要求,通过透明化生产与风险沟通,缓解消费者对基因工程产品的顾虑,推动 MDBPs 在功能食品、临床营养中的应用。
图文赏析
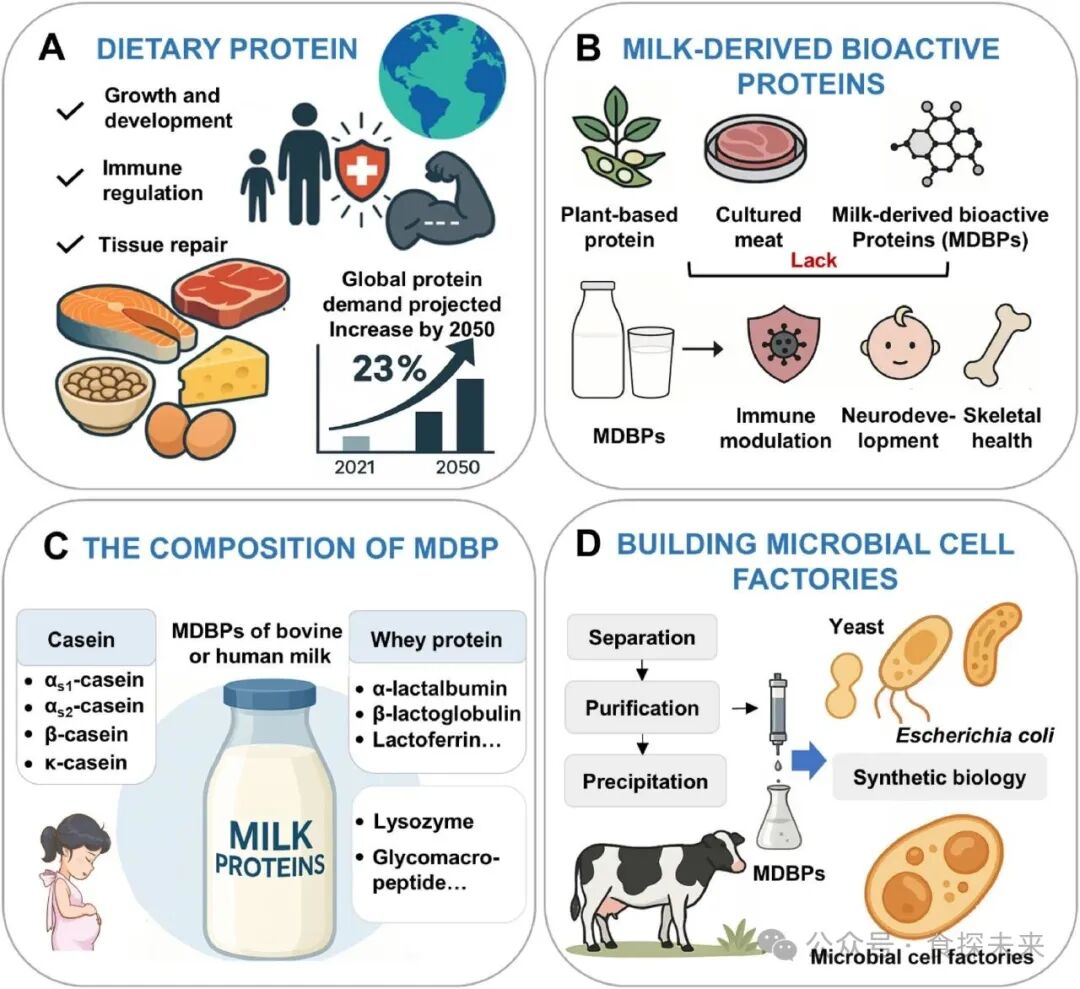
Fig. 1. Overview of dietary protein demand, MDBPs, and MCF strategies for MDBP production. (A) Dietary protein demand and physiological roles. Dietary proteins support growth, immune regulation, and tissue repair. Global protein demand is projected to rise by 23 % from 2021 to 2050. (B) Nutritional gap in alternative proteins. Plant-based proteins and cultured meat lack MDBPs, which contribute to immune modulation, neurodevelopment, and skeletal health. (C) Composition of MDBPs. Bovine and human milk contain caseins, whey proteins, and other functional proteins. (D) Engineering MCFs. Synthetic biology enables MDBP biosynthesis in yeast and E. coli. The source of the picture material: https://www.biorender.com/learn.
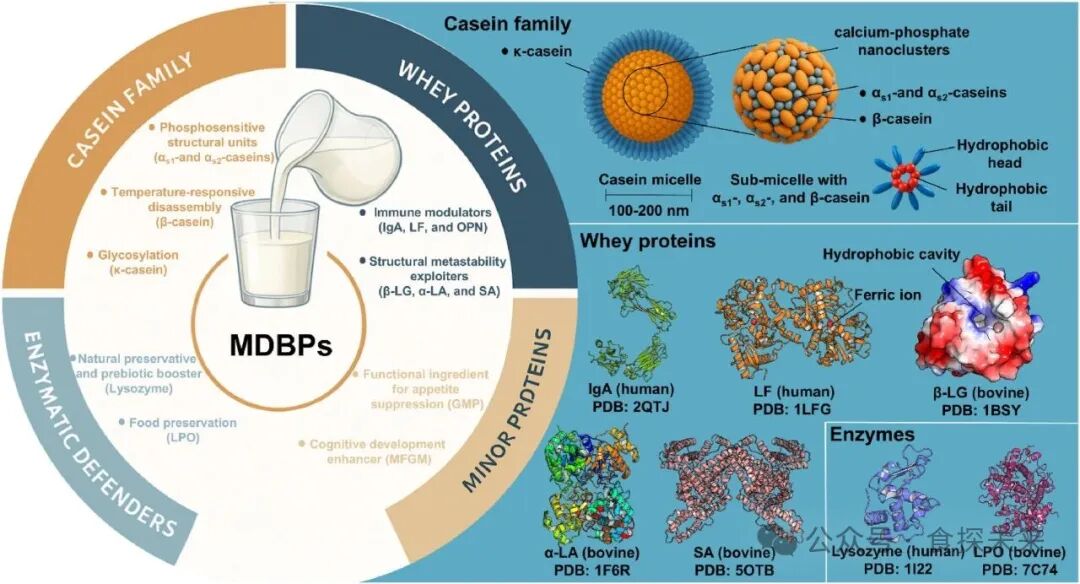
Fig. 2. Structural and functional diversity of MDBPs. MDBPs are classified into caseins, whey proteins, and enzymatic defenders, with additional minor components. Caseins (κ-, β-, αs1-, and αs2-caseins) form nanostructured micelles (100–200 nm) with calcium-phosphate clusters, enabling phosphorylation-dependent assembly, thermal responsiveness, and glycosylation-mediated stability. Whey proteins include immune modulators (IgA, LF, OPN) and structurally dynamic proteins (β-LG, α-LA, SA), illustrated by representative crystal structures. Enzymatic defenders, such as lysozyme and LPO, contribute to antimicrobial defense and food preservation. Minor proteins, including GMP and MFGM components, support appetite regulation and cognitive development. The source of the picture material: https://www.biorender.com/learn.
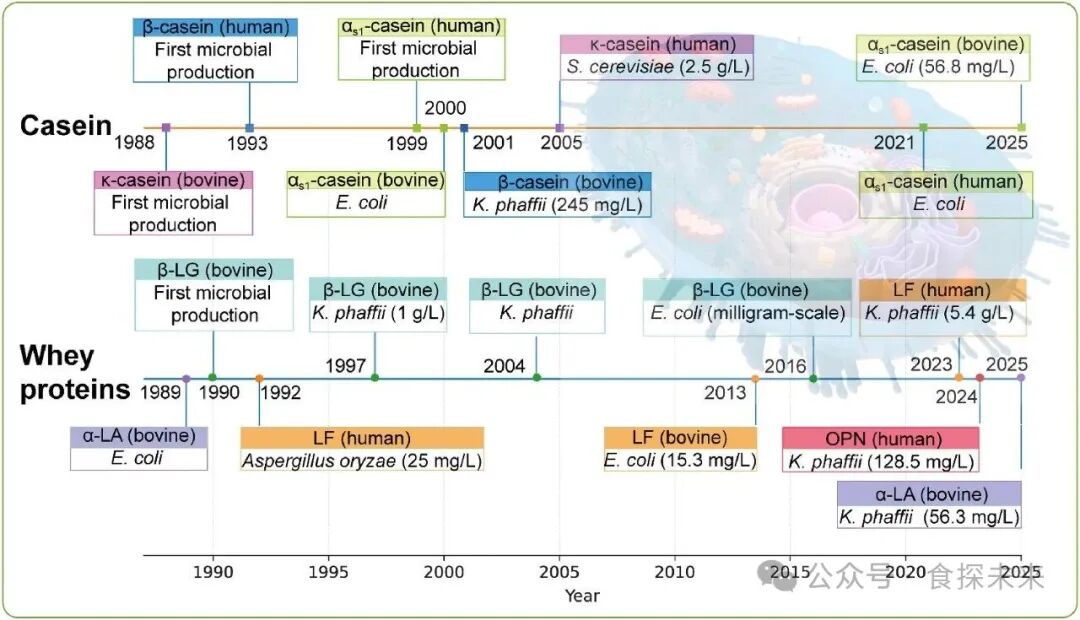
Fig. 3. Timeline of recombinant production of MDBPs in microbial hosts. Chronological milestones for the first microbial production and subsequent optimization of caseins and whey proteins in various hosts. The source of the picture material: https://www.biorender.com/learn.
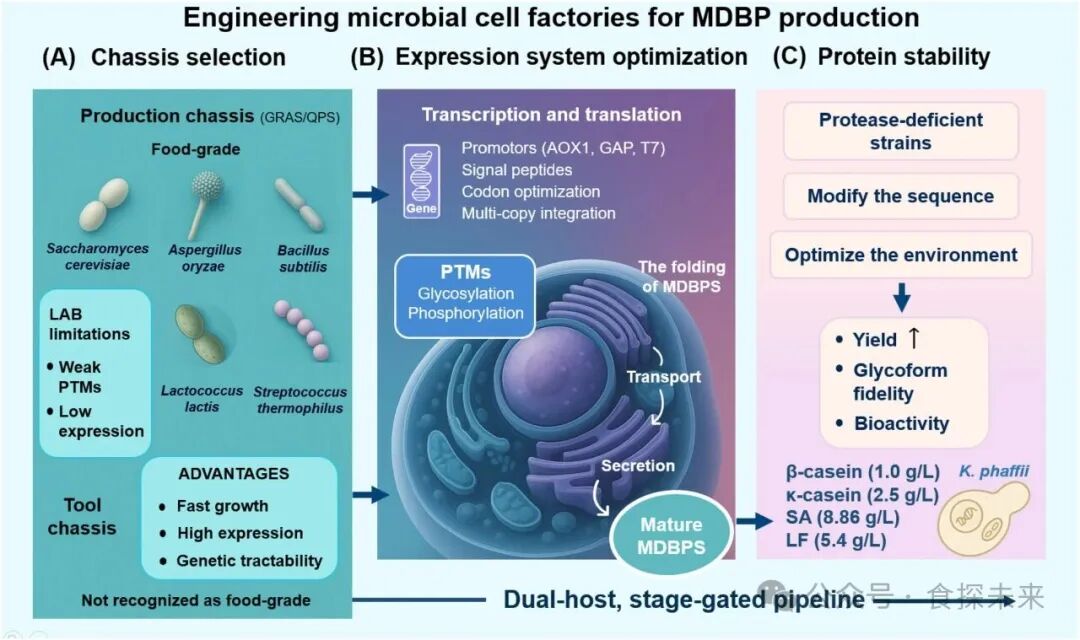
Fig. 4. Engineering microbial cell factories for MDBP production. A dual-host, stage-gated pipeline integrates chassis selection, expression system optimization, and protein stability engineering. The source of the picture material: https://www.biorender.com/learn.
