于文文1,2,3, 吕雪芹1,2, 李兆丰3, 刘龙1,2
1.江南大学未来食品科学中心,江苏 无锡 214122
2.江南大学生物工程学院,糖化学与生物技术教育部重点实验室,江苏 无锡 214122
3.江南大学食品学院,江苏 无锡 214122
Plant synthetic biology and bioproduction of human milk oligosaccharides
YU Wenwen1,2,3, LV Xueqin1,2, LI Zhaofeng3, LIU Long1,2
1.Science Center for Future Foods,Jiangnan University,Wuxi 214122,Jiangsu,China
2.School of Biotechnology,Key Laboratory of Sugar Chemistry and Biotechnology,Ministry of Education,Jiangnan University,Wuxi 214122,Jiangsu,China
3.School of Food Science and Technology,Jiangnan University,Wuxi 214122,Jiangsu,China

母乳低聚糖(human milk oligosaccharides,HMOs)是母乳中仅次于乳糖和脂肪的第三大固体成分,具有调节免疫系统、维持消化健康及促进大脑发育等生理功能。近期,加州大学伯克利分校Patrick M. Shih基于合成生物学使能技术,在模式植物本生烟中重构HMOs代谢合成途径,利用太阳光能将CO2转化为系列HMOs。相关研究为HMOs的生物制造提供了新思路与新范例,扩宽了植物合成生物学在乳基功能营养品可持续发展领域的应用前景。从政策批准和工业应用等角度来看,上述技术仍处于“概念验证”阶段;相比之下,将CO2捕获催化与微生物细胞工厂发酵过程相结合的技术方案,更有望在短期内实现HMOs绿色生物制造的工业应用。
关键词: 母乳低聚糖 ; 生物制造 ; 模式植物 ; 二氧化碳 ; 植物合成生物学
Human milk oligosaccharides (HMOs) are the third largest solid component in breast milk. They have a wide range of applications due to their beneficial physiological functions such as regulating the immune system, maintaining digestive health, and promoting brain development. There is a growing interest in the development of green and efficient bioproduction of HMOs via synthetic biology technologies. Recently, Patrick M. Shih’s team from the University of California, Berkeley, has engineered the model plant Nicotiana benthamiana as a photosynthetic platform for HMOs production. Specifically, the enzymes involved in HMOs biosynthesis were heterologously expressed in the cytosol to reconstruct the metabolic pathways required for HMOs bioproduction. Furthermore, they optimized the productions of HMOs by enhancing the supply of key precursors. Finally, several HMOs were successfully produced from the cost-effective raw materials CO2. The reported study provides deeper insights into the green bioproduction of HMOs, and expands the potential applications of plant synthetic biology technologies in the green and sustainable bioproduction of other dairy-based functional nutraceuticals. From the perspective of regulatory approval and industrial application, the aforementioned technology remains at the proof-of-concept stage. In contrast, an integrated approach combining CO2 capture and conversion with microbial fermentation shows greater potential for demonstrating scalable green biomanufacturing of HMOs in the near term.
Keywords: human milk oligosaccharides ; bioproduction ; model plant ; carbon dioxide ; plant synthetic biology
本文引用格式
于文文, 吕雪芹, 李兆丰, 刘龙. 植物合成生物学与母乳低聚糖生物制造. 合成生物学[J], 2025, 6(5): 992-997 DOI:10.12211/2096-8280.2024-089
YU Wenwen, LV Xueqin, LI Zhaofeng, LIU Long. Plant synthetic biology and bioproduction of human milk oligosaccharides. Synthetic Biology Journal[J], 2025, 6(5): 992-997 DOI:10.12211/2096-8280.2024-089
母乳低聚糖(human milk oligosaccharides,HMOs)是母乳中除乳糖和脂肪之外含量第三丰富的固体营养物质,具有调节免疫系统、维持消化健康及促进大脑发育等生理功能。HMOs主要由D-葡萄糖、D-半乳糖、N-乙酰葡萄糖胺、L-岩藻糖和N-乙酰神经氨酸等5种单体组成。目前,研究人员已成功鉴定出200余种HMOs的结构,并将其划分为中性岩藻糖基乳糖、中性非岩藻糖基化乳糖和酸性唾液酸乳糖三大类[1]。自2015年开始,美国食品药品监督管理局、欧洲食品安全局和澳大利亚和新西兰食品标准局等相继批准2′-岩藻糖基乳糖(2′-fucosyllactose,2′-FL)和乳酰-N-新四糖(lacto-N-neotetraose,LNnT)等HMOs可作为食品添加剂应用至婴幼儿配方奶粉及膳食补充剂等。2023年7月,由中国食品科学技术学会起草的《母乳低聚糖(HMOs)的科学共识》在北京正式发布,该共识为HMOs的科学研究、产品研发和原料审批提供科技支撑,同时为消费者科学认知HMOs提供指导[2]。2023年10月,国家卫健委发布公告批准2′-FL和LNnT可作为食品营养强化剂新品种,添加至婴儿配方食品、较大婴儿和幼儿配方食品以及特殊医学用途婴儿配方食品中。2024年,2′-FL又通过了国家药监局化妆品新原料备案,HMOs的应用范围进一步扩展至美妆领域,市场前景广阔,极具工业生产价值。
在市场和政策的双重激励下,利用合成生物学使能技术构建微生物细胞工厂,将葡萄糖等转化为高附加值的HMOs(图1),已成为当前的研究热点之一。本团队以大肠杆菌(Escherichiacoli)和枯草芽孢杆菌(Bacillussubtilis)为底盘细胞,结合代谢流优化、转运工程和酶工程改造等策略,先后实现了2′-FL、3-岩藻糖基乳糖(3-fucosyllactose,3-FL)、LNnT、乳酰-N-四糖(lacto-N-tetraose,LNT)和6′-唾液酸乳糖(6′-sialactose,6′-SL)等HMOs的高效生物制造[3-7]。以2′-FL为例,本团队以前期构建的双碳源发酵2′-FL细胞工厂为底盘细胞,异源表达来源于Neisseriameningitidis的β-1,4-半乳糖基转移酶,重构乳糖从头合成模块,进而实现了以葡萄糖为唯一碳源进行2′-FL的微生物合成;之后,引入外源性非磷酸化转运系统增强胞内非磷酸化葡萄糖供应,并基于乳糖生物传感器构建乳糖响应型基因回路以动态调控乳糖和2′-FL生物合成模块之间的代谢通量,3 L发酵罐中以葡萄糖为唯一碳源的2′-FL产量和转化率分别达到30.1 g/L和0.15 g/g[6,8]。与此同时,基于生物分子凝聚体在2′-FL细胞工厂中创制人工无膜细胞器,区室化调控2′-FL代谢合成途径能够显著提高其发酵产量[3,9-10]。值得注意的是,近期多项研究结果表明人工无膜细胞器策略在3-FL、LNT和LNnT等细胞工厂中同样具有良好的普适性和应用可行性[5,11]。此外,中国科学院大学姚建铭团队[12]将LNnT生物合成模块整合至E.coli中,并结合转运体工程策略增强LNnT外排效率以减轻胞内产物抑制;之后,揭示解除LNnT限速瓶颈,以葡萄糖和甘油双碳源发酵策略来调节碳通量分布,1000 L发酵罐中LNnT产量高达107.4 g/L。
图1
图1 典型母乳低聚糖代谢合成途径
(pgi—编码葡萄糖-6-磷酸异构酶基因;zwf—编码6-磷酸葡萄糖脱氢酶基因;pfkA—编码磷酸果糖激酶基因;futC—编码α-1,2-岩藻糖基转移酶基因;futA—编码α-1,3-岩藻糖基转移酶基因;St6—编码α-2,6-唾液酸转移酶基因;St3—编码α-2,3-唾液酸转移酶基因;lgtA—编码β-1,3-N-乙酰氨基葡萄糖氨基转移酶基因;lgtB—编码β-1,4-半乳糖基转移酶基因;wbgO—编码β-1,3-半乳糖转移酶基因;LnbB—编码乳酰-N-二糖苷酶基因;TeSA—编码α-1,2‑岩藻糖基转移酶基因;Bf13FT—编码α-1,3/4-糖基转移酶基因)
Fig. 1 Schematic diagram of metabolic pathways for typical human milk oligosaccharides
(pgi—phosphoglucose isomerase gene; zwf—glucose-6-phosphate dehydrogenase gene; pfkA—phosphofructokinase gene; futC—α-1,2-fucosyltransferase gene; futA—α-1,3-fucosyltransferase gene; St6—α-2,6-sialyltransferase gene; St3—α-2,3-sialyltransferase gene; lgtA—β-1,3-N-acetylglucosaminyltransferease gene; lgtB—β-1,4-galactosyltransferase gene; wbgO—β-1,3-galactosyltransferase gene; LnbB—lacto-N-biosidase gene; TeSA—α-1,2-fucosyltransferase gene; Bf13FT—α-1,3/4-fucosyltransferase gene)
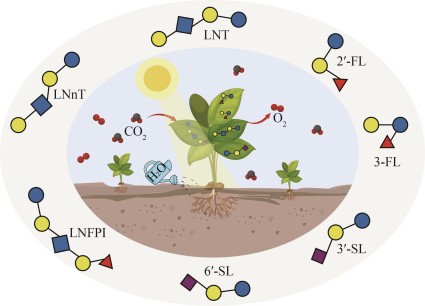
近期,加州大学伯克利分校Patrick M. Shih团队与加州大学戴维斯分校、北卡罗来纳州立大学等[13]合作在NatureFood上发表了以“Engineered plants provide a photosynthetic platform for the production of diverse human milk oligosaccharides”为题的创新研究。在该项工作中,作者认为HMOs的生物合成需要大量的核苷酸糖和糖基化位点,因此选择了具有强大糖代谢能力的模式植物本生烟(Nicotiana benthamiana)作为宿主,将已经揭示的HMOs代谢合成途径整合至N.benthamiana进行异源表达,利用光能将CO2转化为系列HMOs(图2)。该研究首次实现了HMOs在植物细胞中的生物制造。本文对该项研究成果进行阐述,并结合自身团队的相关研究提出一些看法,意在推动HMOs生物制造技术的多元化发展。
图2
图2 植物合成HMOs技术流程
Fig. 2 The workflow of engineered plants for the production of diverse human milk oligosaccharides
首先,作者基于根癌农杆菌介导的高效瞬时表达系统,在N.benthamian细胞质中异源表达两种β-1,4-半乳糖基转移酶GalTPM1141和HPO826、β-1,3-半乳糖基转移酶Cvβ3GalT和β-1,3-N-乙酰氨基葡萄糖基转移酶NmLgtA,成功合成了乳糖、LNT、LNnT以及其他几种五糖和七糖异构体。之后,作者继续研究N.benthamians生物合成中性岩藻糖基乳糖的可行性,即将α-1,2-岩藻糖基转移酶Te2FT和上述中性非岩藻糖基化乳糖合成途径共表达。实验结果证明,成功合成了2′-FL、乳酰‑N‑岩藻糖基五糖Ⅰ(lacto-N-fucopentaose Ⅰ,LNFPⅠ)和其他多种岩藻糖基化的六糖异构体。由于植物不含有酸性唾液酸乳糖合成所需的供体CMP-N-乙酰神经氨酸(cytidine-5′-monophospho-N-acetylneuraminic acid,CMP-Neu5Ac),因此,作者在前期已表达中性非岩藻糖基化乳糖代谢合成途径的基础上,相继异源表达了CMP-Neu5Ac合成途径和两种唾液酸转移酶。具体为在N.benthamiana中异源表达α-2,6-唾液酸转移酶St6实现了6′-SL和唾液酸乳酰-N-新四糖c(sialyllacto-N-neotetraose c,LSTc)的生物合成,表达α-2,3-唾液酸转移酶PmST3则合成了3′-唾液酸乳糖(3′-sialactose,3′-SL)与酸性戊糖化合物LSTd。与之前的混合型产物类似,合成酸性唾液酸乳糖过程中也会产生其他的酸性六糖异构体,这种产物合成的多样性和复杂性也初步证明了N.benthamiana作为HMOs生物制造平台的潜力。
为了进一步证明N.benthamiana生物合成HMOs的工业应用价值,作者利用瞬时表达系统重构LNFPⅠ代谢合成途径。结果显示,每克植物干重中LNFPⅠ含量达到808.91 μg。之后,作者通过表达策略强化了GDP-岩藻糖、UDP-半乳糖和UDP-N-乙酰氨基葡萄糖合成途径在内的核苷酸糖供给模块。其中,强化GDP-岩藻糖合成途径使得LNFPⅠ产量(同样基于干重,本文下同)提高了32.9%,达到1075.03 μg/g,这表明N.benthamiana中的GDP-岩藻糖存在供给不足的问题。此外,作者发现即使不表达α-1,3-或α-1,4-岩藻糖基转移酶,强化GDP-岩藻糖合成途径后N.benthamiana依然能够合成乳-二岩藻四糖(lactodifucotetraose,LDFT)和乳糖-N-二岩藻六糖Ⅰ(lacto-N-difuco-hexaose Ⅰ,LNDFHⅠ),这一结果表明N.benthamiana中存在未知的内源性岩藻糖基转移酶。进一步研究发现,强化核苷酸糖供给模块中不同的生物合成途径可以精细调控HMOs产物的种类和比例。与仅表达LNFPⅠ合成途径相比,同时强化UDP-N-乙酰氨基葡萄糖合成途径可以提高含有己糖和N-乙酰氨基葡萄糖基团的中性低聚糖含量,而同时强化GDP-岩藻糖合成途径则可以促进了至少含有一个去氧己糖基团的低聚糖合成。上述结果证明,N.benthamiana中核苷酸糖供给模块的可编程性为HMOs合成过程的精准调控提供了新方向。最后,作者基于稳定表达系统构建了可合成LNFPⅠ和2′-FL的工程化N.benthamiana,培养4周后2′-FL含量达到130.35 μg/g,LNFPⅠ含量达到6.88 μg/g。虽然利用稳定表达系统构建的N.benthamiana HMO10和HMO11其产量低于利用瞬时表达系统构建的工程N.benthamiana,但HMO10和HMO11具有良好的基因表达持续性和遗传稳定性,因此更适用于大规模HMOs生产应用,而瞬时表达系统则更适用于HMOs植物合成平台构建可行性的初步验证。
通过优化N.benthamiana中HMOs的提取方法,作者证明从N.benthamiana中分离纯化得到的HMOs同样具有促进双歧杆菌生长的生理功能。此外,作者还利用SuperPro Designer v.12开发了HMOs生物制造技术的经济可行性分析模型,并详细计算了利用N.benthamiana和微生物制备LNFPⅠ工艺成本。由于作者认为植物生产HMOs后的生物质仍可以用于生产乙醇,因此,利用N.benthamiana生物制造LNFPⅠ的成本仅为4.9~18.4 USD/kg。相比之下,微生物发酵制备LNFPⅠ的成本高达45 USD/kg。因此,作者认为利用N.benthamiana等模式植物作为HMOs生物制造平台具有显著的成本优势。
上述这一最新研究成果为HMOs的生物制造提供了新颖的角度与方案。从政策方面看,各国目前仅批准了发酵法和化学法生产HMOs的相关应用,推动HMOs植物生产法的批准应用道阻且长。此外,N.benthamiana虽然是植物合成生物学的模式底盘,但考虑到当前HMOs的应用范围(婴幼儿配方奶粉等),其可能并不是HMOs的最适生产平台。利用其他食品植物如番茄、玉米等进行HMOs的植物合成,可能更容易被审核部门和消费者接受。其中,番茄具有广泛的遗传资源和丰富的组学数据库,且瞬时和稳定表达系统完善。2024年,上海交通大学唐克轩团队[14]成功构建了基于真空侵染的高效瞬时表达系统,实现了番茄中基因的快速导入与表达。该系统不仅简化了番茄基因操作,并且加速了合成生物学元件的筛选,为番茄作为HMOs植物合成平台提供了新技术。因此,在番茄中重构HMOs合成途径具有良好的可行性。此外,番茄具有果实结构,其作为植物营养生长后期形成的一种终端结构,不会影响植物的正常营养生长及光合作用。因此,在番茄果实中重构HMOs合成途径,有望实现细胞生长和HMOs合成模块的解偶联,进而实现HMOs的高效合成。从应用范围看,将植物生产HMOs的应用范围推广至养殖行业更具吸引力。在此情况下,含有HMOs的培养植物通过简单的破碎处理即可进行饲料喂养,无需进行提取纯化,应用优势明显[15]。此外,相较于微生物细胞工厂,植物细胞具有更加强大的糖代谢合成能力,因此,将模式植物应用于复杂HMOs的生物合成可以和微生物制造技术形成互补双赢局面。从技术方面看,N.benthamiana中存在未知的内源性岩藻糖基转移酶,这使得N.benthamiana难以合成高纯度的单一HMOs。因此,揭示植物底盘中的相关代谢网络,降低HMOs合成途径与内源代谢网络的交互性,也是未来研究中亟待解决的关键问题之一。此外,相较于微生物合成HMOs,N.benthamiana的HMOs产量较低,其主要原因之一是工业模式微生物具有成熟的基因编辑与代谢调控工具,可以对HMOs代谢网络进行精细调控与全局优化。因此,从长远来看,在模式植物中大力发展基因回路、动态调控和区室化调控等工具策略有望推动植物中HMOs生产水平的再突破[16]。
相较于植物生产平台,作者团队认为微生物发酵制备HMOs在经济成本上仍有改进空间。受这一研究成果启发,我们发现实现以CO2为代表的C1原料的生物利用是降低微生物发酵制备HMOs生产成本的最佳途径。CO2是含量最丰富的碳源,2024年全球CO2含量预计达到3.6万亿吨。截至目前,研究人员已经揭示了6条天然固碳途径,并额外设计了5条人工固碳途径。其中,部分固碳途径已经成功在异养微生物中异源表达[17]。然而,改造后的异养微生物CO2利用率相对较低,其主要原因是固碳过程需要消耗大量胞内ATP。光能、电能等可持续再生能源是驱动CO2固定利用的理想能量来源。因此,在未来的相关研究中,选择光合自养微生物如蓝藻作为HMOs生物制造的底盘细胞进行重构改造将是较为理想的解决方案之一[18]。此外,合成生物学与化学、材料科学的交叉融合也是大势所趋。2016年,加州大学伯克利分校的杨培东教授[19]首次构建了光驱动微生物杂合系统,将光能转化为化学能。之后,各种原位/异位耦合系统相继被开发应用。因此,将热/电/光催化与生物制造过程耦合以搭建混合系统,即利用热/电/光催化将CO2转化为甲醇、乙酸盐等作为微生物发酵碳源,有望在短时间内显著降低微生物发酵制备HMOs的经济成本[20-21]。其中,热/电/光催化与生物制造过程的兼容性与连续性是构建此类混合系统的关键要素。以电催化-生物制造异位耦合系统为例,在选择电解质和催化剂时,需要着重考虑电催化产物生产速率与微生物消耗速率的适配性以及产物溶液对微生物细胞生长的干扰性。前者可以通过调控催化剂性能或设置中间存储缓冲装置实现高度适配,后者则可以利用固态电解质电解池合成高纯度发酵碳源,进而直接用于后续的微生物发酵[21]。此外,如何利用空气而非高纯度CO2进行高纯度复杂发酵碳源(C3+产物等)的高效催化合成将是推动此类混合系统工业应用的关键。
参考文献
View Option
[1]
ZHU L Y, LI H Y, LUO T, et al.
Human milk oligosaccharides: a critical review on structure, preparation, their potential as a food bioactive component, and future perspectives
[J]. Journal of Agricultural and Food Chemistry, 2023, 71(43): 15908-15925.
[本文引用: 1]
母乳低聚糖(HMOs)的科学共识
[J]. 中国食品学报, 2023, 23(6): 452-457.
[本文引用: 1]
The Chinese Institute of Food Science and Technology.
Scientific consensus on human milk oligosaccharides (HMOs)
[J]. Journal of Chinese Institute of Food Science and Technology, 2023, 23(6): 452-457.
[本文引用: 1]
[3]
YU W W, JIN K, WANG D D, et al.
De novo engineering of programmable and multi-functional biomolecular condensates for controlled biosynthesis
[J]. Nature Communications, 2024, 15(1): 7989.
[本文引用: 2]
[4]
LIAO C, XU X H, HUANG H Y, et al.
Construction of a plasmid-free Escherichia coli strain for lacto-N-neotetraose biosynthesis
[J]. Systems Microbiology and Biomanufacturing, 2024, 4(3): 965-982.
[5]
HUANG H Y, YU W W, XU X H, et al.
Combinatorial engineering of Escherichia coli for enhancing 3-fucosyllactose production
[J]. ACS Synthetic Biology, 2024, 13(6): 1866-1878.
[本文引用: 1]
[6]
ZHANG Q W, LIU Z M, XIA H Z, et al.
Engineered Bacillus subtilis for the de novo production of 2′-fucosyllactose
[J]. Microbial Cell Factories, 2022, 21(1): 110.
[本文引用: 1]
[7]
CHEN Q, XU X H, SUN Z Y, et al.
Metabolic engineering of Bacillus subtilis for de novo synthesis of 6′-sialyllactose
[J]. Systems Microbiology and Biomanufacturing, 2025, 5: 223-236.
[本文引用: 1]
[8]
ZHANG Q W, XU X H, ZHANG W, et al.
De novo 2′-fucosyllactose biosynthesis using glucose as the sole carbon source by multiple engineered Bacillus subtilis
[J]. Metabolic Engineering, 2025, 88: 85-93.
[本文引用: 1]
[9]
WAN L, ZHU Y Y, ZHANG W L, et al.
Phase-separated synthetic organelles based on intrinsically disordered protein domain for metabolic pathway assembly in Escherichia coli
[J]. ACS Nano, 2023, 17(11): 10806-10816.
[本文引用: 1]
[10]
JI M Q, YAO B H, ZHOU J Y, et al.
Engineering a silk protein-mediated customizable compartment for modular metabolic synthesis
[J]. ACS Synthetic Biology, 2024, 13(12): 4180-4190.
[本文引用: 1]
[11]
WAN L, ZHU Y Y, KE J T, et al.
Compartmentalization of pathway sequential enzymes into synthetic protein compartments for metabolic flux optimization in Escherichia coli
[J]. Metabolic Engineering, 2024, 85: 167-179.
[本文引用: 1]
[12]
LIAO Y X, LAO C W, WU J Y, et al.
High-yield synthesis of lacto-N-neotetraose from glycerol and glucose in engineered Escherichia coli
[J]. Journal of Agricultural and Food Chemistry, 2024, 72(10): 5325-5338.
[本文引用: 1]
[13]
BARNUM C R, PAVIANI B, COUTURE G, et al.
Engineered plants provide a photosynthetic platform for the production of diverse human milk oligosaccharides
[J]. Nature Food, 2024, 5(6): 480-490.
[本文引用: 1]
[14]
YAO X H, TAHERI A, LIU H, et al.
Improvement and application of vacuum-infiltration system in tomato
[J]. Horticulture Research, 2024, 11(9): uhae197.
[本文引用: 1]
A comprehensive framework for the production of plant-based molecules
[J]. Nature Food, 2024, 5(6): 461-462.
[本文引用: 1]
植物合成生物学的现在与未来
[J]. 合成生物学, 2020, 1(4): 395-412.
[本文引用: 1]
Present and future of plant synthetic biology
[J]. Synthetic Biology Journal, 2020, 1(4): 395-412.
[本文引用: 1]
基于二氧化碳的生物制造: 从基础研究到工业应用的挑战
[J]. 合成生物学, 2021, 2(6): 854-862.
[本文引用: 1]
CO2 based biomanufacturing: from basic research to industrial application
[J]. Synthetic Biology Journal, 2021, 2(6): 854-862.
[本文引用: 1]
[18]
JODLBAUER J, ROHR T, SPADIUT O, et al.
Biocatalysis in green and blue: cyanobacteria
[J]. Trends in Biotechnology, 2021, 39(9): 875-889.
[本文引用: 1]
[19]
SAKIMOTO K K, WONG A B, YANG P D.
Self-photosensitization of nonphotosynthetic bacteria for solar-to-chemical production
[J]. Science, 2016, 351(6268): 74-77.
[本文引用: 1]
微生物电合成技术转化二氧化碳研究进展
[J]. 合成生物学, 2024, 5(5): 1142-1168.
[本文引用: 1]
CHEN Y, ZHANG K, QIU Y J, et al.
Progress of microbial electrosynthesis for conversion of CO2
[J]. Synthetic Biology Journal, 2024, 5(5): 1142-1168.
[本文引用: 1]
[21]
ZHENG T T, ZHANG M L, WU L H, et al.
Upcycling CO2 into energy-rich long-chain compounds via electrochemical and metabolic engineering
[J]. Nature Catalysis, 2022, 5: 388-396.
[本文引用: 2]
