
在食品工业中,寻找理想的蔗糖替代品已成为主流趋势。由于过度摄入传统糖类与多种健康问题相关,消费者和制造商都将目光投向了天然甜味剂。其中,源自甜叶菊(Stevia rebaudiana)的甜菊糖苷因其高甜度、零热量等特性备受青睐。近期,一种非天然的甜菊糖苷衍生物——莱鲍迪苷M8(Reb M8),引起了业界的极大关注。Reb M8是莱鲍迪苷D(Reb D)的结构衍生物,不仅展现出优越的感官特性(高甜度、无苦涩后味),还具有独特的抗肿瘤坏死因子-α(TNF-α)的生物活性,这使其成为极具潜力的下一代甜味剂。因此,实现Reb M8的规模化生产具有重要的工业价值。
目前,Reb M8的生物合成依赖于一种关键的生物催化剂——糖基转移酶UGT94E13。研究人员此前已通过工程改造获得了催化效率增强的突变体UGT94E13-F169G/I185G(本文中称为M0)。然而,这个为催化活性而优化的酶却面临一个致命的弱点:热稳定性差。在工业生物制造中,酶的稳定性至关重要,它直接决定了生产过程的成本、效率和可持续性。一个不稳定的酶无法承受长时间或较高温度的反应条件,这极大地限制了Reb M8的工业化应用。因此,如何提升M0的热稳定性,同时不损害其来之不易的催化活性,成为了该领域亟待解决的核心技术瓶颈。
这项研究的精妙之处在于,它并非从零开始,而是对一个已有的、经过优化的酶进行“二次修复”。这揭示了现代生物技术中一个普遍的范式:自然提供的酶是起点,但工业应用的需求往往需要通过蛋白质工程进行迭代优化。第一次工程改造解决了活性问题,却带来了稳定性问题,这正是酶工程中经典的“活性-稳定性权衡”(activity-stability trade-off)困境。本研究的目标,就是通过更精巧的工程策略,打破这一困境。
面对提升酶稳定性的挑战,研究者摒弃了传统的“大海捞针”式的随机突变方法,而是采用了一种高效、精准的计算机辅助理性设计策略。这种策略的核心优势在于,它能够基于蛋白质的结构和功能信息,预测性地筛选出最有可能成功的突变位点,从而将需要实验验证的突变库规模降至最低。
更进一步,该研究并未依赖单一的计算工具,而是构建了一个强大的组合式工作流程:
1. 初始候选突变生成: 研究人员首先使用两种业界知名的蛋白质稳定性预测工具——PROSS和FireProt,对M0蛋白结构进行独立分析。这两个工具基于不同的算法模型,分别预测出40个和51个可能提高热稳定性的突变位点,形成了一个庞大的初始候选库。
2. 交叉验证与智能过滤: 为了提高预测的准确性,研究团队对两个候选库取交集,找出共同预测的突变位点。随后,他们引入了两个基于生物学基本原理的关键过滤器,对候选列表进行精炼:
o 结构分析过滤: 剔除所有距离酶活性口袋小于8 Å的突变。这是为了保护酶的核心催化区域,避免引入的突变干扰底物结合或催化过程,从而最大程度地保留酶的原始活性。
o 进化保守性分析过滤: 利用Consurf分析,剔除在进化过程中高度保守的氨基酸残基(保守性评分大于8)。这些残基通常对蛋白质的折叠、结构或功能至关重要,改变它们极有可能导致酶失活。
3. 最终突变库的确定: 经过这一系列智能化的筛选和过滤,最初近百个候选突变被大幅缩减至仅剩12个单点突变。这一高效的筛选流程,完美融合了计算机的强大算力与生物化学的深刻洞见,确保了后续实验验证的高成功率。
这种设计策略的创新性不仅在于使用了先进的计算工具,更在于将这些工具的预测结果与蛋白质生物化学的核心原则(保护活性中心)和进化生物学的规律(尊重保守残基)相结合。这种“计算+生物学启发式”的混合方法,有效规避了纯计算设计可能带来的功能灾难性突变的风险,是本次研究得以成功的关键前提。
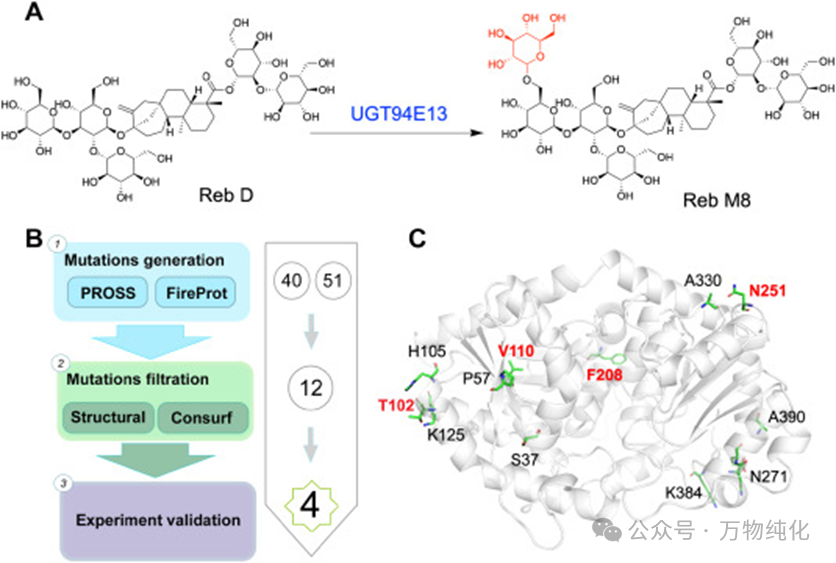
图1. 通过组合诱变工程改造UGT94E13以增强其热稳定性
2.1 初步筛选:单点突变的验证与评估
研究团队对筛选出的12个单点突变体进行了表达纯化,并逐一评估了它们的热稳定性和催化活性。热稳定性的核心评价指标是熔解温度(Tm),即蛋白质一半变性时的温度。结果显示,与起始酶M0(Tm = 49.08 °C)相比,除了N271E之外的11个突变体均表现出Tm值的提升,这有力地证明了前期设计策略的有效性。
其中,有五个突变体(P57L, T102D, V110I, F208Y, N251E)的Tm值提升超过了1 °C,表现尤为突出。然而,稳定性提升只是成功的一半。在随后的活性测试中,P57L突变体虽然稳定性不错,但其催化活性却降至M0的59%,因此被淘汰。这再次凸显了同时评估稳定性和活性的重要性。最终,研究人员锁定了四个“精英”单点突变:T102D、V110I、F208Y和N251E。这四个突变体均实现了显著的稳定性增益(ΔTm > 1 °C),同时保持了90%以上的原始催化活性。
表1. M0单点突变的ΔTm值和相对活性
酶 |
ΔTm (°C) |
相对活性 (%) |
M0 |
0 |
100±1.47 |
F208Y |
2.75 |
100±1.26 |
T102D |
1.41 |
94±1.04 |
V110I |
1.31 |
105±2.77 |
P57L |
1.04 |
59±9.69 |
N251E |
1.03 |
103±8.28 |
A390E |
0.87 |
98±2.69 |
A330P |
0.76 |
102±12.27 |
S37P |
0.60 |
99±0.66 |
K125L |
0.39 |
92±6.5 |
H105K |
0.35 |
91±8.65 |
K384N |
0.25 |
104±8.49 |
N271E |
-0.49 |
80±15.53 |
此外,对最适反应温度(Topt)的测定进一步证实了这些突变的功能性热稳定性增强。T102D、V110I和F208Y的最适温度均从M0的35 °C提升到了40 °C,这意味着它们在更高温度下能更高效地工作。
2.2 组合的力量:协同效应与性能飞跃
为了探寻稳定性的极限,研究人员采用了一种“贪婪算法”策略,将四个精英突变进行组合。他们根据ΔTm的贡献大小,逐步叠加这些突变,构建了M1至M5五个组合突变体。测试结果令人振奋:组合突变体的热稳定性呈现出明显的累加甚至协同效应。最终的四点突变体M5 (M0-T102D/V110I/F208Y/N251E) 的Tm值相比M0飙升了5.40 °C,达到了惊人的54.48 °C。
在活性方面,数据揭示了突变之间复杂的相互作用。例如,包含T102D的M1和M3突变体活性有所下降(分别为60%和74%),这表明某些突变组合可能带来负面影响。然而,当引入N251E形成最终的M5时,活性不仅没有下降,反而恢复并提升至M0的108%。这一现象暗示N251E突变可能起到了某种结构或动态上的补偿作用,修复了其他突变组合带来的不利构象变化,这体现了蛋白质工程中非线性效应的复杂与精妙。
表2. M0及其组合突变体的热稳定性和相对活性
酶 |
ΔTm (°C) |
相对活性 (%) |
M0 |
0 |
100±1.47 |
M1 |
3.67 |
60±0.28 |
M2 |
3.28 |
102±2.91 |
M3 |
4.48 |
74±1.79 |
M4 |
3.34 |
106±1.30 |
M5 |
5.40 |
108±2.01 |
稳定性的提升在实际应用中意味着更长的使用寿命。通过测定40 °C下的热失活半衰期(t1/2),M5的表现堪称卓越。其半衰期长达8.89小时,而M0仅为0.60小时,提升了惊人的14.8倍。这一指标直接关系到工业生产中的酶成本,是M5最具应用价值的优势之一。
最后,对M0和M5的酶促动力学参数进行了比较。结果显示,M5对底物Reb D的米氏常数Km值从0.215 mmol/L增加到0.393 mmol/L,表明底物亲和力有所下降,这可能是由于酶整体刚性增加所致。然而,其催化常数kcat值与M0相当,综合催化效率(kcat/Km)虽略有下降,但其在高温下的长效稳定性足以弥补这一点,并且在实际测试中总产量更高。
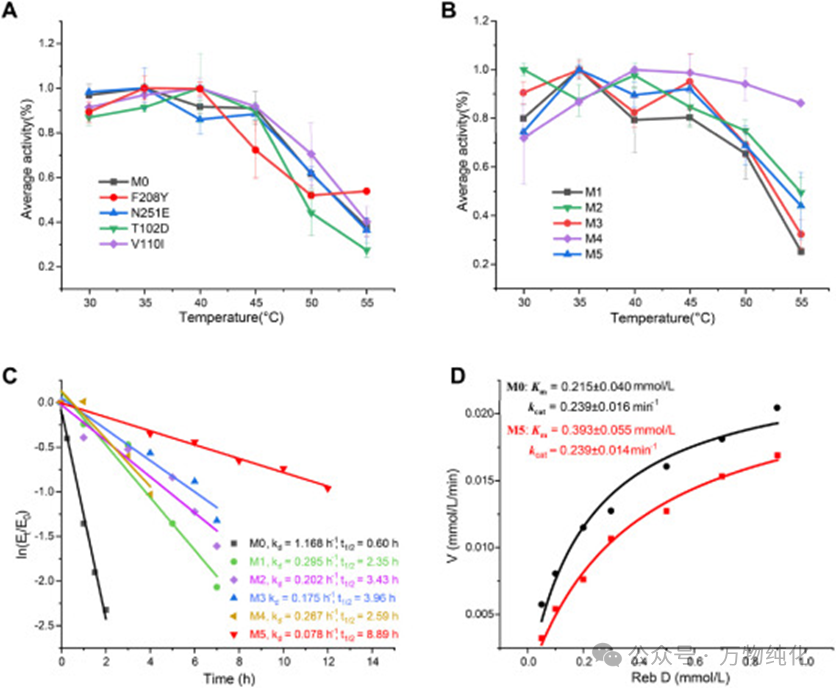
图2. M0及其突变体的热稳定性表征
3.1 揭示热稳定性的结构奥秘
为了从分子层面解释M5为何如此稳定,研究人员对其三维结构模型进行了深入分析,揭示了四个突变协同作用的精巧机制:
· T102D: 将102位的苏氨酸(T)替换为天冬氨酸(D),引入的羧基侧链与邻近的赖氨酸K125形成了一个新的盐桥。这个静电相互作用像一把“锁”,将局部结构域牢牢固定,显著增强了该区域的刚性。
· V110I: 将110位的缬氨酸(V)替换为体积更大的异亮氨酸(I)。这个看似微小的改变,却能更有效地填充蛋白内部的疏水核心,增强了与周围疏水残基的范德华相互作用,减少了空腔体积,从而使蛋白质结构更加紧凑和坚固。
· F208Y: 将208位的苯丙氨酸(F)替换为酪氨酸(Y),引入的羟基与158位的谷氨酸(E158)的羧基形成了一个新的氢键。这个额外的化学键进一步限制了局部肽链的柔性,为蛋白质的稳定性贡献了一份力量。
· N251E: 这是一个位于蛋白质表面的突变,将中性的天冬酰胺(N)替换为带负电的谷氨酸(E)。此举优化了蛋白质表面的静电势分布,缓解了局部的静电排斥,促进了更有利的远程静电相互作用,这是一种被证实能有效提升热稳定性的表面电荷工程策略。
这四种机制——盐桥、疏水堆积、氢键和表面电荷优化——共同作用,像是在蛋白质结构的关键节点上增加了多个“铆钉”和“支撑梁”,极大地增强了酶的整体刚性,使其能够抵抗高温带来的解折叠趋势。
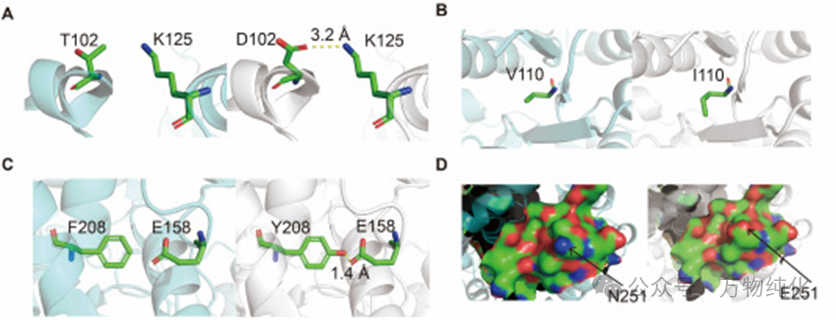
图3. 突变体M5热稳定性增强的分子机制分析
3.2 利用分子动力学模拟破解“活性-稳定性”悖论
最令人好奇的问题是:M5在变得更“僵硬”的同时,为何催化活性反而略有提升?为了解答这个悖论,研究团队进行了100纳秒的分子动力学(MD)模拟。
首先,通过分析蛋白质骨架的均方根涨落(RMSF),模拟结果证实了M5的整体刚性确实高于M0。然而,当视线聚焦于活性口袋内部时,答案浮出水面。模拟分析了催化反应中的两个关键距离:d1(催化质子提取的距离)和d2(糖基转移的距离)。结果发现,在M5的模拟体系中,这两个关键距离相比M0都显著缩短了(d1从6.05 Å缩短至5.00 Å,d2从7.83 Å缩短至4.74 Å)。
这一发现至关重要。它表明,这四个突变虽然增强了酶的整体稳定性,但它们协同作用的最终结果,是“锁定”了一个催化上更有利的构象。换句话说,增加的刚性并非均匀地“冻结”了整个酶,而是巧妙地预组织了活性中心,使得底物和关键催化残基处于一个近乎“完美”的反应位置。这种构象上的优化,缩短了反应发生的物理距离,从而弥补甚至超越了因整体刚性增加可能带来的活性损失,最终实现了活性和稳定性的同步提升。这并非简单的加固,而是一种更高级的、功能导向的结构优化。
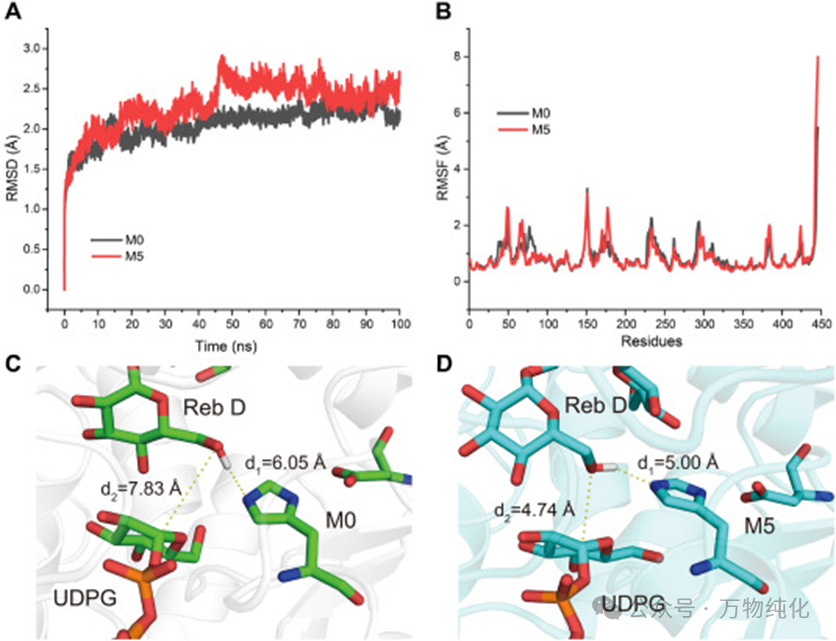
图4. 分子动力学模拟分析
4.1 设计经济高效的级联催化体系
在实际生产中,糖基转移反应需要一个昂贵的糖基供体——尿苷二磷酸葡萄糖(UDPG)。为了降低成本,研究人员设计了一个级联催化体系。他们将工程改造后的M5酶与来自拟南芥的蔗糖合酶(AtSuSy)联用。AtSuSy可以利用廉价的蔗糖和UDP,源源不断地再生UDPG,从而为M5提供“弹药”,使整个过程在经济上变得可行。
4.2 生物过程的优化
在使用粗酶液进行的级联反应中,研究团队对反应条件进行了系统优化。结果确定了最佳条件为:在pH 7.5的磷酸钾(KPi)缓冲液中,以500 mmol/L的蔗糖为底物,于45 °C下进行反应。值得注意的是,这个45 °C的最佳反应温度,显著高于M0的最适温度,这直接体现了M5热稳定性改造所带来的实际应用优势,使其能够在更高效的温度区间内工作。
4.3 终极对决:M0与M5的补料分批发酵生产
在优化的条件下,研究人员进行了一场为期6小时的“终极对决”,直接比较了M0和M5在Reb M8生产中的表现。
生产曲线清晰地展示了两者间的巨大差异。在反应初期,两种酶的催化效率相当。但30分钟后,M0的活性开始明显衰减,到2小时后几乎完全失活,最终产量定格在31.28 g/L。相比之下,M5在第一个小时内保持了高活性,并在随后的4小时里持续稳定地生产Reb M8,最终产量达到了35.30 g/L。
虽然最终产量的提升(约13%)也相当可观,但更具工业意义的指标是操作寿命的延长。M5的有效工作时间长达5小时,而M0仅为2小时,操作寿命延长了2.5倍。这意味着在实际生产中,使用M5可以大幅减少酶的添加量,降低生产成本,提高设备利用率,这正是此次热稳定性工程改造最核心的成功标志。
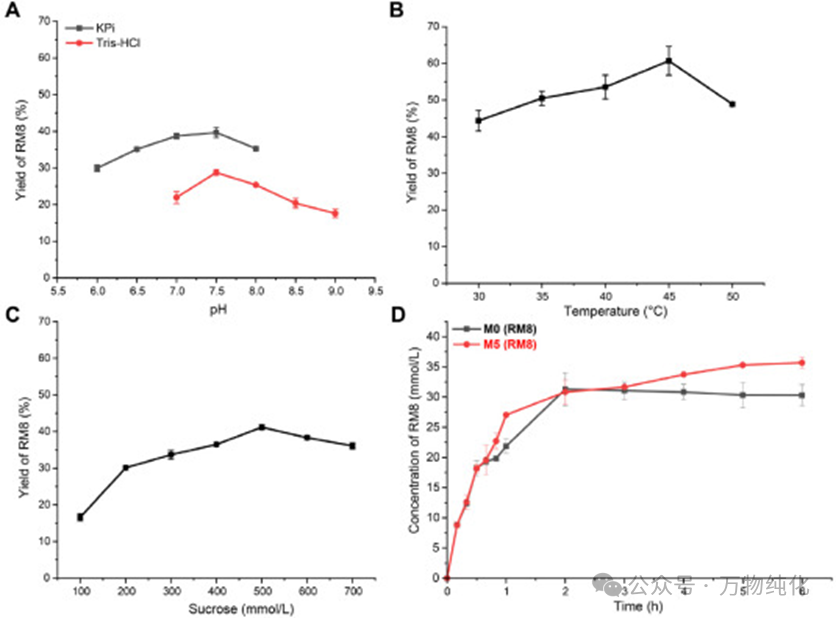
图5. 通过UGT94E13和AtSuSy级联反应补料分批生产Reb M8
总而言之,这项研究通过一种集计算预测、结构分析和进化保守性分析于一体的组合式理性设计策略,成功地攻克了糖基转移酶UGT94E13的热稳定性难题。最终获得的四点突变体M5,在Tm值提升5.4 °C、半衰期延长14.8倍的同时,还实现了108%的相对催化活性,完美地打破了酶工程中常见的“活性-稳定性”权衡的束缚。
更重要的是,研究不仅创造了一个性能优越的酶,还通过结构分析和分子动力学模拟,从原子层面清晰地阐释了其性能提升的分子机制——即通过盐桥、氢键、疏水堆积和表面电荷优化的协同作用增强稳定性,并通过锁定催化有利构象来维持甚至提升活性。在应用层面,M5在级联催化体系中展现出卓越的生产性能和操作稳定性,实现了35.30 g/L的Reb M8产量,为其工业化应用铺平了道路。
这项工作不仅为高价值甜味剂Reb M8的生物制造提供了一个强大的、可工业化的生物催化剂,更重要的是,它为解决其他工业酶所面临的类似挑战,提供了一个高效、普适的方法学框架。它展示了如何通过多维度、信息驱动的设计策略,精准地调控酶的性能,为未来更复杂的酶工程项目提供了宝贵的蓝图。
