
文献标题
De novo production of 1,3-olein-2-palmitin (OPO) and 1-olein-2-palmitin-3-linolein (OPL) by multiplexed reconstruction of lipid metabolism in yeasts文章来自Metabolic Engineering(中科院一区 TOP,IF 6.8),聚焦母乳脂肪(HMFs)核心成分 OPO(1,3 - 油酸 - 2 - 棕榈酸甘油三酯)和 OPL(1 - 油酸 - 2 - 棕榈酸 - 3 - 亚油酸甘油三酯)的微生物从头合成,通过重构酿酒酵母脂质代谢网络,突破酰基转移酶底物偏好、脂肪酸组成限制等瓶颈,实现高效生产,为功能脂质工业化提供新方案。
研究背景
OPO 和 OPL 是母乳脂肪中最丰富的结构脂质(占总甘油三酯 TAG 的 20%-40%),其独特的 U-P-U 结构(sn-2 位为棕榈酸 P,sn-1/3 位为不饱和脂肪酸 U)能促进婴儿营养吸收与矿物质利用,是婴儿配方食品的关键成分。传统生产依赖酶催化,成本高(约 6 美元 / 千克),而微生物合成基于可再生碳源(如葡萄糖),成本可降至 1.2-5.9 美元 / 千克,具有显著优势。
酿酒酵母因遗传背景清晰、基因操作简便、可合成大量脂质,成为理想宿主,但存在三大瓶颈限制 OPO/OPL 高效合成:
1. 内源酰基转移酶(LPAT、GPAT)底物偏好不饱和脂肪酸,导致棕榈酸(C16:0)难以定向酯化至 sn-2 位;
2. 脂肪酸组成不适配:C16:0 和油酸(C18:1)比例低,且无法合成亚油酸(C18:2),限制 OPO 合成并阻碍 OPL 生产;
3. 二酰甘油酰基转移酶 DGA1 催化效率低,是 TAG 合成的关键瓶颈,直接制约产物产量。
本研究通过 “重构 HMF 合成模块 - 修饰脂肪酸组成 - 优化代谢流 - 定向进化关键酶” 的系统策略,在酿酒酵母中实现 OPO 和 OPL 的高效从头合成。
本研究采用多模块协同代谢工程策略,核心方法如下:
· 异源表达偏好 C16:0-CoA 的酰基转移酶(拟南芥 rmBnLPAT1、莱茵衣藻 mCrlPAAT1/2),并融合内质网(ER)信号肽,确保酶定位至 TAG 合成位点;
· 敲除内源偏好不饱和脂肪酸的 LPAT 基因(SLC1、ALE1、LOA1),减少底物竞争,强化 C16:0 在 sn-2 位的酯化。
· 替换内源 Δ9 去饱和酶 OLE1 为P. graminis PgOLE1(偏好 C18:0),降低棕榈油酸(C16:1)比例,提升 C18:1 含量;
· 表达小鼠脂肪酸延长酶 MmELVOL6,将 C16:0 转化为硬脂酸(C18:0),进一步提升 C18:1 产量;
· 异源表达解脂耶氏酵母 Δ12 去饱和酶 FAD2,构建 C18:2 合成通路,实现 OPL 从头合成;优化 FAD2 表达强度(选用 CCW12p 启动子),平衡 C18:1 与 C18:2 比例。
· 前体供给强化:表达解脂耶氏酵母乙酰辅酶 A 羧化酶 YliACC1,提升丙二酰 - CoA(脂肪酸合成前体)含量;整合异源乙酰 - CoA 合成通路(XPK-PTA),增强碳源流向脂肪酸合成;敲除 β- 氧化关键基因 POX1,减少脂肪酸降解;
· 产物合成强化:敲除 TAG 脂酶基因 TGL3/4,减少 TAG 降解;过表达磷脂酸磷酸酶 PAH1 和二酰甘油酰基转移酶 DGA1,强化 TAG 合成;过表达甘油激酶 GUT1,提升甘油 - 3 - 磷酸(TAG 骨架前体)供应。
· 易错 PCR 构建 DGA1 随机突变库,通过荧光激活细胞分选(FACS)结合 BODIPY 505/515 染色(中性脂质标记),高通量筛选催化活性提升的突变体;
· 测序鉴定优势突变体(DGA1L275V),整合至工程菌株优化产物合成。
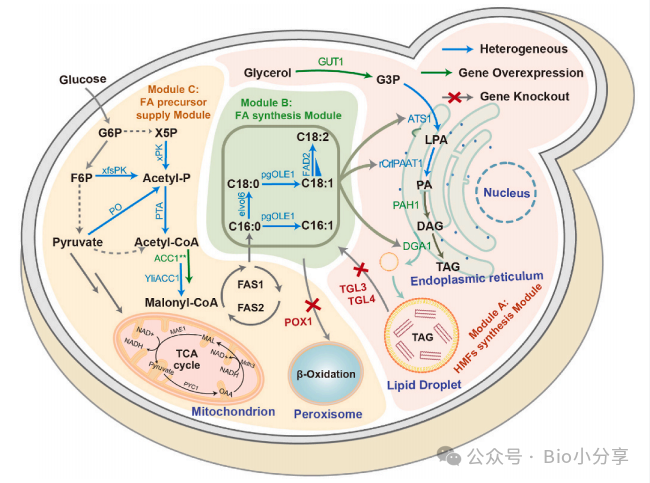
Fig1:HMF 合成模块重构与 OPO 从头合成
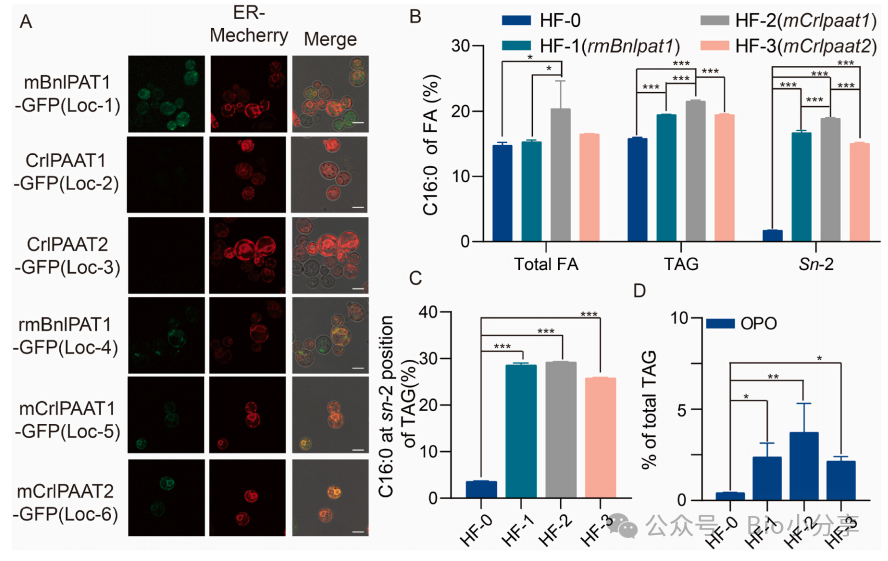
Fig2:异源溶血磷脂酸的可视化及其对HF-0菌株脂肪酸组成和OPO合成的影响
1. 仅融合 ER 信号肽的修饰型 LPAT 可锚定至 ER(TAG 合成核心位点),未修饰 LPAT 在细胞内分散分布,无法参与 TAG 合成;
2. 表达 mCrlPAAT1 的 HF-2 菌株效果最优 —— 总脂质中 C16:0 占比从 HF-0 的 10.38±0.45% 升至 20.38±4.25%,TAG 中 C16:0 占比从 15.84±0.18% 升至 21.54±0.14%,sn-2 位 C16:0 占比从 1.71±0.05% 升至 18.90±0.11%;
3. HF-1~HF-3 均实现 OPO 从头合成,HF-2(mCrlPAAT1)的 OPO 占比最高(3.73±1.58%),HF-1(rmBnLPAT1)、HF-3(mCrlPAAT2)分别为 2.37±0.76%、2.15±0.25%,证明异源 LPAT 的 C16:0 底物偏好可定向引导酰基至 sn-2 位。

Fig3. 异源和天然LPAT联合表达对FA组成和OPO合成的影响
1. 随着内源 LPAT(SLC1、ALE1、LOA1,均偏好不饱和脂肪酸)逐步敲除,总脂质与 TAG 中不饱和脂肪酸(C16:1、C18:1)占比下降,饱和脂肪酸(C16:0、C18:0)占比上升。HF-8(ΔSLC1+ΔALE1+ΔLOA1+mCrlPAAT1)的 TAG 中 C16:0 占比从 HF-0 的 15.84±0.18% 升至 25.24±0.14%,C16:1 占比从 38.80±0.04% 降至 33.86±0.16%;
2. HF-8 的 sn-2 位 C16:0 占比达 40%,TAG 中 C16:0 在 sn-2 位的酯化率超 50%,较 HF-0(3.60%)提升 13.9 倍;仅敲除内源 LPAT(无 mCrlPAAT1)的菌株,C16:0 提升幅度不足 HF-8 的 1/3,证明 “异源表达 + 内源敲除” 存在协同效应;
3. HF-8 的 OPO 占总 TAG 比例达 7.00±0.18%,较未敲除内源 LPAT 的 HF-2(3.73%)提升 87.7%。
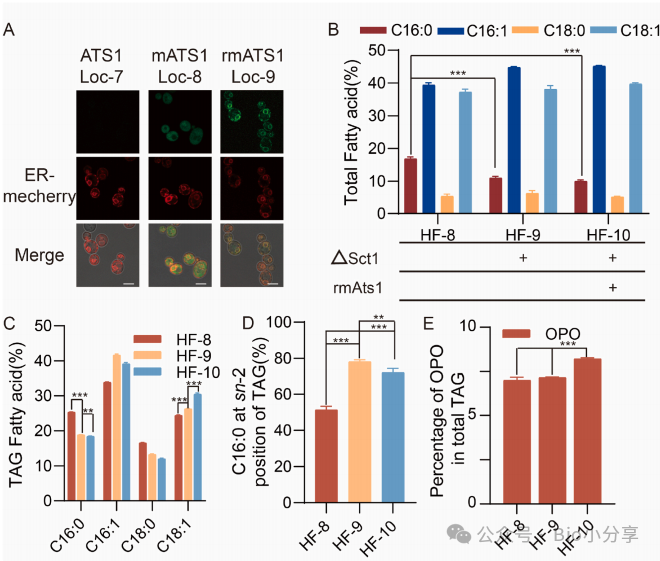
Fig4. GPAT 优化定向改善 TAG 酰基分布
1. 删除 ATS1 的叶绿体信号肽(mATS1)可实现胞内表达,叠加 ER 信号肽(rmATS1)可锚定至 ER,解决植物源 GPAT 在酵母中的定位难题;
2. 敲除内源偏好 C16:0 的 GPAT(SCT1)后,HF-9 的 TAG 中 C16:0 占比从 HF-8 的 25.24% 降至 18.39%,但 sn-2 位 C16:0 酯化率升至 > 78%;表达 rmATS1(偏好 C18:1-CoA)的 HF-10,TAG 中 C18:1 占比从 HF-9 的 24.34% 升至 30.45%,匹配 OPO“sn-1/3 位为不饱和脂肪酸” 的结构需求;
3. HF-10 的 OPO 占总 TAG 比例达 8.2%,较 HF-9(无 rmATS1)提升 5.1%。

Fig5. 脂肪酸组成修饰实现OPO和 OPL 从头合成
1. PgOLE1 是来自 P. graminis 的 Δ9 去饱和酶,底物偏好 C18:0。HF-11(PgOLE1 替换 OLE1)的总脂质中 C16:1 占比从 HF-10 的 45.18% 降至 32.08%,C18:1 占比从 39.71% 升至 47.40%;HF-12(叠加 MmELVOL6)的 C16:1 进一步降至 18.49%,C18:1 升至 61.73%,OPO 比例达 26.59%;
2. HF-13(表达解脂耶氏酵母 FAD2)首次在酿酒酵母中实现 C18:2 合成,总脂质中 C18:2 占比达 31.22%,C18:1 降至 33.73%,成功构建 OPL 从头合成通路;
3. HF-13 的 OPO 与 OPL 占总 TAG 比例分别为 19.12±2.74%、14.92±1.76%,证明脂肪酸组成修饰可同时满足两种 HMF 核心成分的合成需求。

1. 表达 YliACC1 的 HF-15,TAG 产量达 23.51±2.61 mg/g DCW(较 HF-13 提升 42.3%);整合 xpk-PTA 通路的 HF-19,TAG 产量进一步升至 27.30±3.87 mg/g DCW;
2. 敲除 TAG 脂酶 TGL3/4 的 HF-20~HF-21,TAG 产量较 HF-19 提升 15%-20%;过表达 PAH1(磷脂酸磷酸酶)与 DGA1(二酰甘油酰基转移酶)的 HF-24,TAG 产量达 73.60±0.74 mg/g DCW;
3. 过表达甘油激酶 GUT1(提升 TAG 骨架前体)的 HF-32,TAG 产量达 81.20±2.92 mg/g DCW(较 HF-19 提升 197.8%),且 OPO/OPL 滴度达 12.35 mg/L、5.84 mg/L。
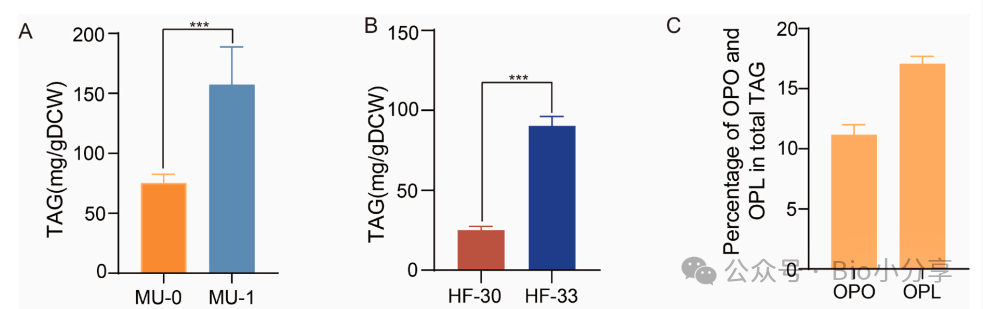
1. 通过易错 PCR 构建 DGA1 突变库,结合荧光激活细胞分选(FACS,BODIPY 染色),获得 MU-1 突变体,测序确认 DGA1 第 275 位亮氨酸→缬氨酸(DGA1L275V);
2. 整合 DGA1L275V 的 HF-33,TAG 产量达 90.38±5.83 mg/g DCW,较未突变菌株 HF-30(25.17 mg/g DCW)提升 259.0%;
3. HF-33 的 OPL 占总 TAG 比例达 17.08%,超过 OPO(11.18%),实现两种产物的高效协同合成。

Fig8:菌株HF-34/35在3L生物反应器放大验证
1. 34 h 进入稳定期(OD600=30.45);44 h 停止葡萄糖补料(避免乙醇过度积累,此时乙醇浓度达峰值);73 h DCW 达 9.9±0.26 g/L,细胞利用残留乙醇持续合成产物;
2. 73 h TAG 产量达 114.71±4.36 mg/g DCW,总 TAG 滴度 1.14±0.07 g/L;
3. 73 h OPO 与 OPL 滴度分别达 130.48 mg/L、88.35 mg/L,较摇瓶水平(HF-32 的 12.35 mg/L、5.84 mg/L)提升 10.6 倍、15.1 倍。
4. HF-35 的细胞密度(OD600=20.85)低于 HF-34,但 TAG 产量(127.19 mg/g DCW)更高,证明 DGA1L275V 突变在放大培养中仍能维持高催化活性;
5. HF-35 的 OPL 滴度(162.30 mg/L)显著高于 HF-34(88.35 mg/L),且为目前文献报道中 “以葡萄糖为唯一碳源” 的最高 OPL 产量。
本研究通过多模块协同代谢工程,在酿酒酵母中首次实现 OPO 和 OPL 的高效从头合成,核心突破如下:
1. 重构 HMF 合成模块,通过异源表达 ER 定位的 C16:0 偏好型 LPAT + 敲除内源 LPAT,实现 sn-2 位 C16:0 酯化率超 70%;
2. 修饰脂肪酸组成,引入 FAD2 通路实现 OPL 从头合成,平衡 C18:1 与 C18:2 比例;
3. 结合推拉策略与 DGA1 定向进化,TAG 产量提升 3.86 倍,达 127.19 mg/g DCW;
4. 3-L 生物反应器中,OPO 和 OPL 最高滴定度分别达 130.48 mg/L 和 162.30 mg/g,为目前报道最高水平。
该研究为母乳脂肪替代物的绿色生产提供了高效微生物平台,也为其他结构化功能脂质的合成提供了 “酰基转移酶优化 - 脂肪酸组成修饰 - 代谢流强化” 的通用策略。
文章链接
https://doi.org/10.1016/j.ymben.2025.11.005
