
研究背景
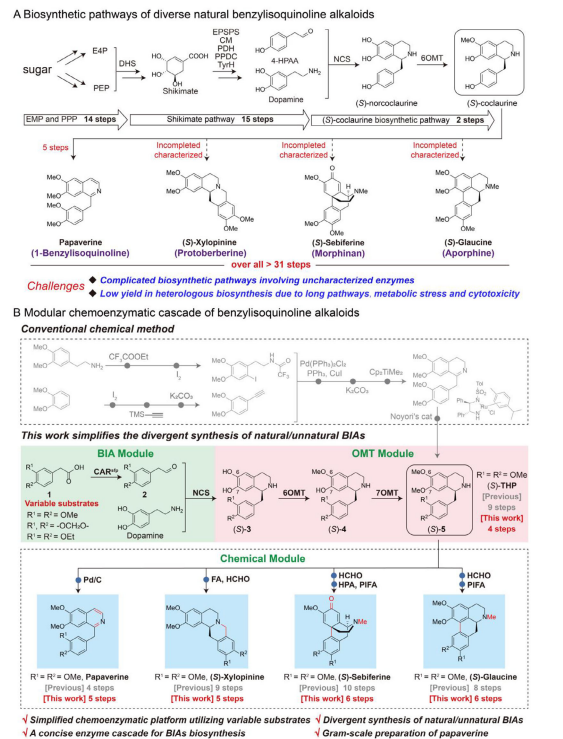
植物来源的苄基异喹啉生物碱(BIAs)具有广泛的生理活性,但其传统提取方法受限于含量低、气候与地理因素等,而化学全合成常因手性中心多、官能团复杂而依赖昂贵催化剂与繁琐步骤。微生物异源合成虽具潜力,但受限于酶表达效率、底物特异性及代谢负担等问题。因此,亟需开发高效、简洁且可规模化的合成策略,以实现结构多样化的天然与非天然BIAs的绿色合成。研究内容近日,江南大学糖化学与生物技术教育部重点实验室饶义剑团队在Advanced Science期刊上发表了题为“A Modular Chemoenzymatic Cascade Simplifies Divergent Synthesis of Natural and Unnatural Benzylisoquinoline Alkaloids”的论文。设计了一种模块化的化学酶级联平台,通过四酶催化级联合成关键手性中间体(S)-四氢罂粟碱((S)-THP),并结合一至两步化学转化,实现了对四类BIAs(1-苄基异喹啉、原小檗碱、吗啡喃和阿朴啡类)的高效、立体选择性合成。该平台在300 mL体系中达到3.33 g/L的(S)-THP产量,并成功合成包括罂粟碱、(S)-木兰花碱、(S)-乌药碱和(S)-格劳辛在内的多种天然与非天然BIAs,对映选择性高达99% ee。
文章亮点
1. 模块化平台设计:提出“酶催化模块+化学模块”的级联策略,将复杂BIAs的合成路径简化为5–6步,显著优于传统化学合成(8–10步)或微生物全合成(29步以上)。
2. 高效手性中间体合成:通过酶工程改造(如P₅N7OMT-S119T和P₅OMT2-I113R突变体)提升催化效率,实现(S)-THP的高产率(81%)与高对映选择性(98% ee)。
3. 多样化产物衍生能力:利用(S)-THP及其衍生物,通过简洁化学步骤合成多种天然与非天然BIAs,包括难以通过生物合成获得的乙基取代类似物。
4. 工业化潜力:在300 mL规模中实现克级产量,罂粟碱产量达2.83 g/L,为目前生物法合成最高水平,展现出良好的可扩展性与应用前景。
5. 绿色可持续性:避免使用重金属催化剂与复杂保护/脱保护步骤,符合绿色合成理念,为药物开发提供新路径。
结论与展望
该研究所开发的模块化化学酶级联平台,成功实现了对多种天然与非天然苄基异喹啉生物碱(BIAs)的高效、高立体选择性发散式合成。该策略通过整合酶催化与化学合成的优势,巧妙地绕过了传统全合成步骤冗长、微生物异源表达效率低等瓶颈,为复杂手性天然产物的绿色制造提供了新的范式。展望未来,该平台展现出巨大的应用潜力与拓展空间。首先,其模块化设计具有高度的通用性,可通过替换底物或引入新的酶/化学模块,进一步拓展至其他类型生物碱或高价值手性分子的合成,为药物先导化合物的快速挖掘与结构优化提供强大工具。其次,平台已展现出可观的规模化生产能力,若能结合发酵优化与过程工程,有望推动包括镇痛、抗肿瘤活性BIAs在内的关键药物中间体的工业化生产,降低对植物提取的依赖。此外,该工作中基于理性设计的酶工程策略,也为解决其他生物合成途径中关键酶的活性与选择性瓶颈提供了可借鉴的方法。总之,这一研究不仅为BIAs的高效合成开辟了新路径,更强化了化学与生物学工具融合在合成生物学与绿色制药领域的核心价值,为未来天然产物的人工生物制造奠定了坚实的技术基础。
文献来源
H. Liu, Z. Yuan, Y. Gao, et. al., A Modular Chemoenzymatic Cascade Simplifies Divergent Synthesis of Natural and Unnatural Benzylisoquinoline Alkaloids, Adv. Sci., 2025, e13926.
链接:https://doi.org/10.1002/advs.202513926
