
文章🔗:https://doi.org/10.1016/j.fbio.2025.107617
根皮苷(Phlorizin),一种主要存在于苹果皮中的二氢查耳酮糖苷,因其卓越的抗氧化、抗炎、抗癌及心脏保护活性,在医药、食品和化妆品领域备受瞩目。在医学上,它作为钠-葡萄糖协同转运蛋白(SGLT)的抑制剂,在2型糖尿病治疗中扮演着重要角色;在化妆品中,它能抑制酪氨酸酶活性,具有美白淡斑的功效。
然而,如此珍贵的天然产物却面临着严重的供应难题。传统的植物提取法因其在植物中含量极低而成本高昂、产量有限;化学合成法则因步骤繁琐、收率低下且使用有毒试剂而难以规模化。因此,发展绿色、可持续的生物合成路线成为满足市场需求的迫切选择。
近年来,科学家们已成功在E. coli等微生物中重建了根皮苷的生物合成途径,但产量始终在毫克级别徘徊(例如11.6 mg/L),远未达到工业化生产的要求。究其原因,一个核心瓶颈在于关键的糖基转移酶——UGT88F1。这类源于高等植物的酶在微生物宿主中表达时,往往表现出催化活性低、稳定性差的通病,成为了整个合成途径的限速步骤。因此,这项发表于Food Bioscience的研究,正是要攻克这一难题,通过对UGT88F1进行精准的蛋白质工程改造,打开高效生物合成根皮苷的大门。这项工作不仅关乎根皮苷的生产,更是在为解决合成生物学领域一个普遍性难题——优化真核酶在原核底盘中的功能——提供一个经典的示范。
面对UGT88F1活性不足的挑战,研究团队采用了一套结合了计算模拟与实验验证的精妙策略,堪称理性设计的典范。
第一步:In Silico奠定基础。 研究人员首先利用先进的AlphaFold 3工具预测了UGT88F1的三维结构,并通过拉氏图验证了其高质量,为后续设计提供了可靠的蓝图。随后,通过分子对接技术,将底物根皮素(phloretin)和辅底物UDPG“放入”酶的活性口袋中,构建了酶-底物三元复合物模型。这一步精准地锁定了活性口袋中与根皮素距离在5 Å范围内的20个关键氨基酸残基,它们成为了改造的“靶点”。
第二步:实验筛选与验证。 基于计算预测,研究团队展开了系统的诱变筛选。首先进行丙氨酸扫描,即将20个靶点残基逐一突变为丙氨酸。结果清晰地指向了三个“热点”残基——P11、P85和I145,它们的突变分别使酶活提升了1.38倍、1.70倍和1.35倍。随后,对这三个热点进行更深入的半饱和突变,发现P85位点替换为更小的丙氨酸(A)或甘氨酸(G)效果最好,而P11位点只有丙氨酸突变有效,I145位点则是丙氨酸或天冬氨酸(D)能提升活性。
第三步:组合协同,优中选优。 最后,研究人员将最优的单点突变进行组合。结果显示,双突变体UGT88F1-P85A/I145A表现出最强的协同效应,其催化活性相较于野生型酶,实现了1.93倍的显著提升。这一结果揭示了野生型UGT88F1活性口袋内可能存在一定的空间位阻。通过将结构刚性的脯氨酸(P85)和侧链庞大的异亮氨酸(I145)替换为小巧的丙氨酸,为底物结合与催化过程创造了更优越的空间环境,体现了酶工程中“少即是多”的精妙哲学。
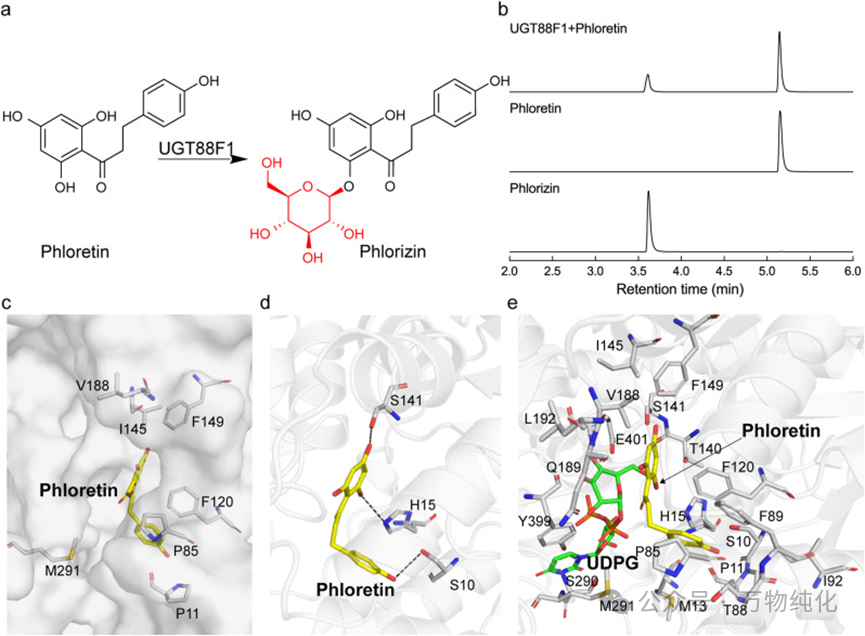
图1. UGT88F1催化根皮素糖基化形成根皮苷。(a) UGT88F1将根皮素转化为根皮苷的糖基化反应示意图;(b) UPLC分析显示UGT88F1将根皮素转化为根皮苷;(c) 结合口袋中预测与根皮苷形成疏水相互作用的关键氨基酸残基;(d) 结合口袋中预测与根皮素形成氢键的关键氨基酸残基;(e) UGT88F1活性位点内5 Å范围内氨基酸残基的概述。
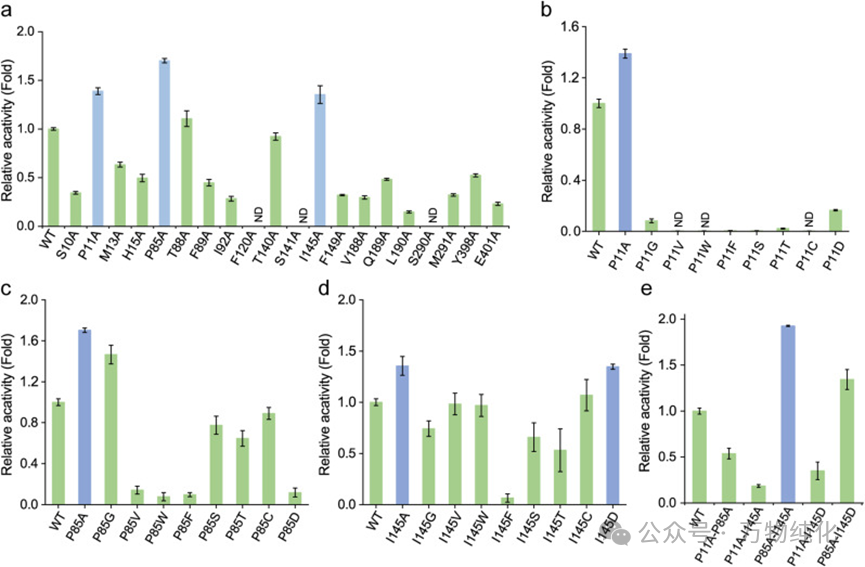
图2. 结构引导工程糖基转移酶UGT88F1以提高其催化活性。(a) UGT88F1的丙氨酸扫描诱变结果;(b) P11残基的半饱和诱变结果;(c) P85残基的半饱和诱变结果;(d) I145残基的半饱和诱变结果;(e) 组合突变体的催化活性分析。
突变体为何会变得更高效?为了从分子层面回答这个问题,研究团队运用了分子动力学(MD)模拟这一强大工具,对野生型和P85A/I145A突变体酶与底物的动态互作过程进行了长达100纳秒的“现场直播”。
根据已知的糖基转移酶催化机理,催化残基H15会夺取根皮素2'-羟基上的质子,使其成为一个亲核试剂,进而攻击UDPG上葡萄糖的C1原子,完成糖基化反应。因此,两个关键距离至关重要:一是H15与根皮素2'-羟基氢原子之间的距离(决定质子转移效率),二是根皮素2'-羟基氧原子与UDPG葡萄糖C1原子之间的距离(决定亲核攻击效率)。
MD模拟的结果令人振奋:P85A/I145A突变显著缩短了这两个关键距离。H15与羟基氢原子的平均距离从野生型的3.96 Å大幅缩短至2.81 Å;而羟基氧原子与C1原子的平均距离也从5.98 Å缩短至3.92 Å。这表明,突变重塑了活性口袋的构象,使得底物能够以一种更接近“攻击”姿态的构象(near-attack conformation)被更稳定地“锚定”在催化中心。这种对活性位点的“预组织”优化,使得催化事件发生的概率大大增加,从根本上解释了突变体催化效率提升的分子机制。
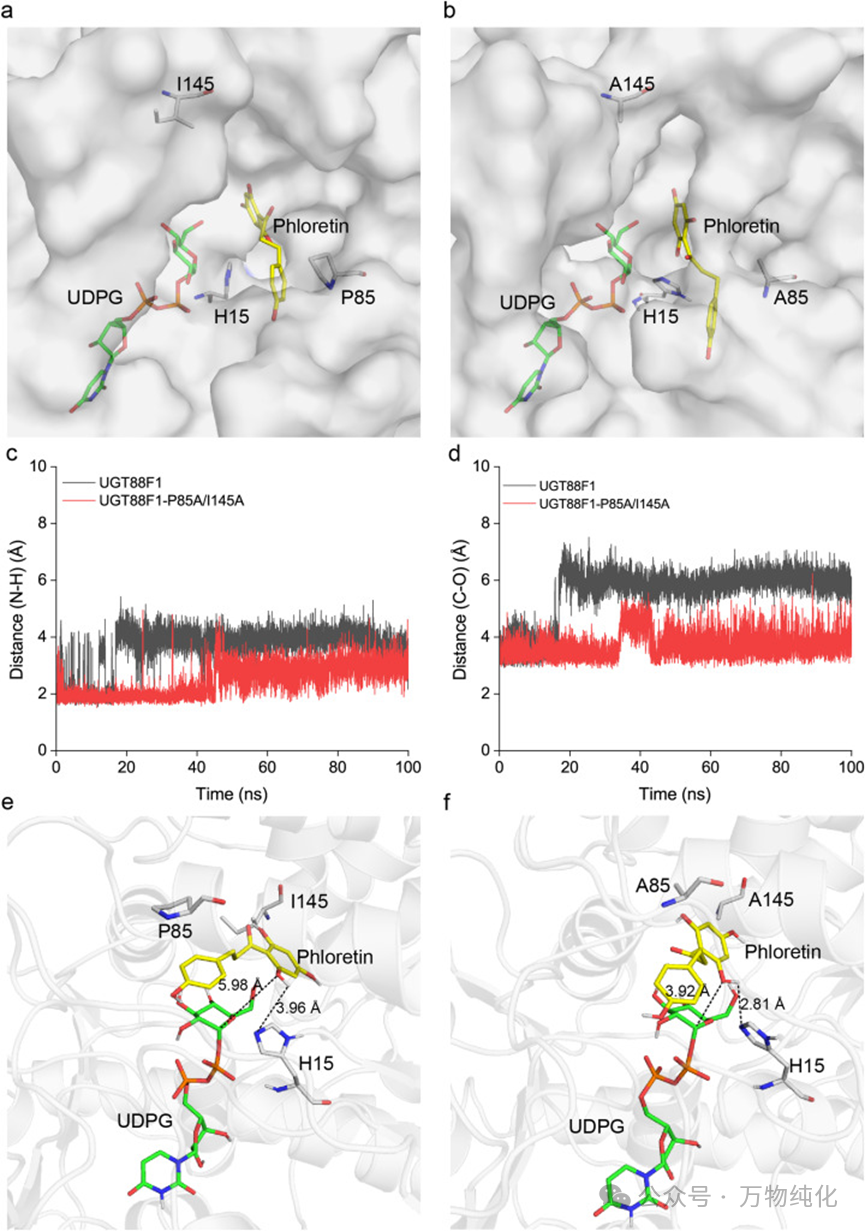
图3. UGT88F1-P85A/I145A突变体催化活性增强的机制分析。(a) P85和I145在结合口袋中的位置;(b) A85和A145在结合口袋中的位置;(c) 活性位点残基H15的ε-氮原子与根皮素2-羟基的氢原子之间的距离;(d) 根皮素2-羟基的氧原子与UDP-葡萄糖C1原子之间的距离;(e) MD模拟中UGT88F1的代表性催化构象;(f) MD模拟中UGT88F1-P85A/I145A的代表性催化构象。
为了给计算模拟的发现提供坚实的实验证据,研究人员对纯化的野生型及突变体酶进行了详细的酶学性质表征。首先,确定了酶的最适反应条件,发现所有突变体在pH 9.5-10.5的碱性环境和40-50 °C的温度范围内均表现出高活性。
随后,关键的酶动力学参数测定结果(见下表)完美印证了MD模拟的预测。与野生型相比,所有突变体的Km值均有不同程度的降低,表明它们与底物根皮素的结合亲和力更高,这正是底物定位优化的直接体现。更重要的是,所有突变体的kcat值(转换数)均显著提高,其中双突变体P85A/I145A的kcat值达到了29.4 s-1,是野生型的1.70倍,说明其催化化学步骤的速度更快。
综合亲和力与催化速度,最终的催化效率(kcat/Km)指标显示,P85A/I145A突变体达到了706.1 mM-1s-1,相较于野生型提升了1.88倍。这一系列翔实的数据,将“活性提升1.93倍”这一宏观结果分解为“结合更紧”和“转化更快”两个微观层面的贡献,构成了从理论预测到实验验证的完整闭环。
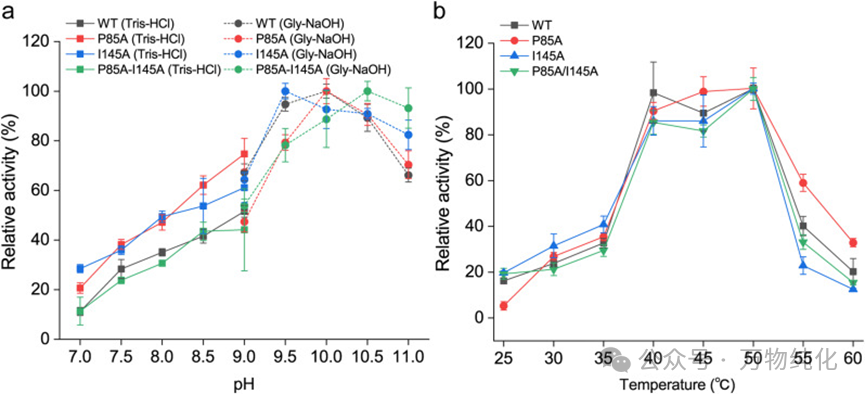
图4. UGT88F1及其突变体催化条件优化。(a) UGT88F1及其突变体催化的根皮素转化为根皮苷体系中pH的优化;(b) UGT88F1及其突变体催化的根皮素转化为根皮苷体系中温度的优化。
表1. UGT88F1及其突变体对根皮素的动力学参数
Variants |
Km (μM) |
kcat (s-1) |
kcat/Km (mM-1s-1) |
UGT88F1-WT |
47.6 |
17.3 |
374.4 |
UGT88F1-P85A |
24.5 |
14.3 |
583.9 |
UGT88F1-I145A |
44.2 |
28.0 |
634.2 |
UGT88F1-P85A/I145A |
41.6 |
29.4 |
706.1 |
尽管获得了性能卓越的突变酶,但工业化之路仍有一个“拦路虎”:糖基供体UDP-葡萄糖(UDPG)价格昂贵,大规模使用会带来巨大的成本压力。为此,研究团队设计了一个巧妙的体外双酶级联催化系统。
他们将工程改造后的UGT88F1-P85A/I145A与来自拟南芥的蔗糖合酶(AtSuSy)进行共表达,利用廉价的蔗糖和催化量的UDP,原位、持续地再生UDPG,从而解决了成本问题。随后,团队对这个级联反应体系的pH、温度、蔗糖浓度和UDP浓度等关键参数进行了系统优化。
有趣的是,级联系统的最适pH为7.0,而纯化的UGT88F1突变体最适pH却在9.5-10.5之间。这一差异恰恰反映了多酶催化系统开发的真实挑战与智慧:最终的工艺条件并非追求单个酶的最优,而是要找到一个能平衡体系中所有组分活性与稳定性的“折衷点”。这体现了从基础酶学研究迈向实际应用时,必须进行的系统性工程考量。
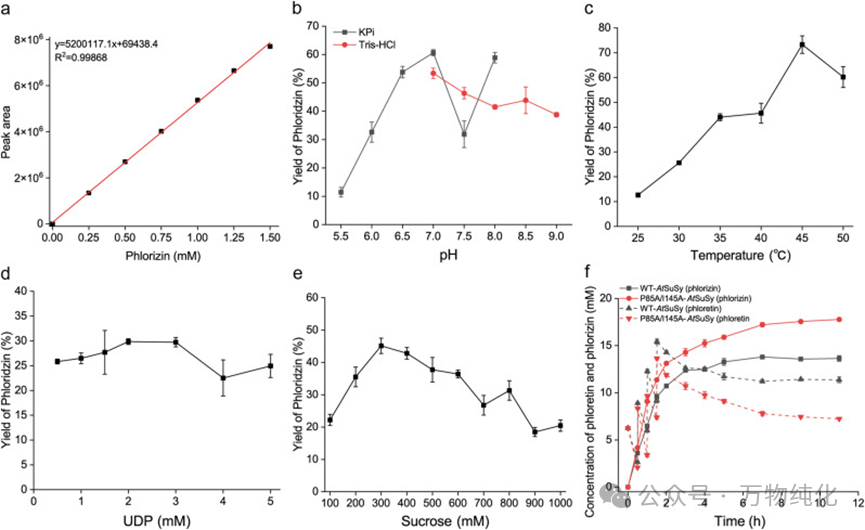
图5. UGT88F1-P85A/I145A-AtSuSy级联反应制备根皮苷的条件优化。(a) 根皮苷的标准曲线;(b) 酶级联体系中pH的优化;(c) 酶级联体系中温度的优化;(d) UDP浓度在酶级联体系中的优化;(e) 蔗糖浓度在酶级联体系中的优化;(f) 级联反应中根皮苷的补料分批合成。
在最优化的条件下(45 °C, pH 7.0, 300 mM蔗糖, 2.0 mM UDP),研究人员采用补料分批发酵策略,在10 mL反应体系中进行了根皮苷的制备。最终,经过11小时的反应,该级联系统成功将根皮素转化为目标产物,最终滴度(titer)高达8.39 g/L,摩尔转化率达到71.04%。这一产量远超以往报道的微生物de novo合成水平,充分展示了该策略的巨大潜力。
总而言之,这项研究为我们呈现了一个从理论设计、酶学改造、机理阐明到工艺优化和高产合成的完整“从基因到克级产量”的研发范例。它不仅为根皮素的工业化生物制造提供了高效的生物催化剂和可行的技术路线,也为其他依赖糖基化修饰的珍贵天然产物的生物合成提供了宝贵的借鉴。
当然,正如作者所指出的,从实验室走向工厂仍有挑战需要克服,例如进一步提高酶的热稳定性以适应更长的生产周期、降低酶制剂的生产成本以及开发高效、可规模化的下游纯化工艺等。但毫无疑问,这项工作已经为根皮素的绿色制造铺平了道路,让我们对未来充满期待。
