
2025年6月,江南大学糖化学与生物技术教育部重点实验室吕雪芹研究员团队在国际权威期刊《Trends in Biotechnology》(影响因子:14.3)上发表了题为《Light-induced programmable solid–liquid phase transition of biomolecular condensates for improved biosynthesis》的最新研究成果。
本研究聚焦于人工构建的生物分子凝聚体在代谢工程中的动态调控问题,提出了一种利用光控蛋白酶系统实现生物凝聚体固-液相可编程转换的新策略,可根据发酵过程中的具体需求,精准地维持或调节其流动性。
这项技术突破性地解决了传统凝聚体在长时间发酵过程中逐渐“固化”的问题,为发酵中后期酶底物的高效传递和反应提供了理想微环境。
通过蓝光诱导TEV蛋白酶在特定位点剪切无序结构域(IDPs),研究人员成功实现了在酿酒酵母中对凝聚体物理性质的精准调控,并显著提高了角鲨烯(squalene)和熊果酸(ursolic acid)等高附加值天然产物的合成效率,分别提升了32.4%与46.4%。
该研究不仅在技术层面丰富了合成生物学调控手段的“工具箱”,也为未来高效微生物细胞工厂的构建提供了新思路,展现了光控蛋白相变调节策略在代谢工程、天然产物合成乃至医学领域的广阔应用前景。
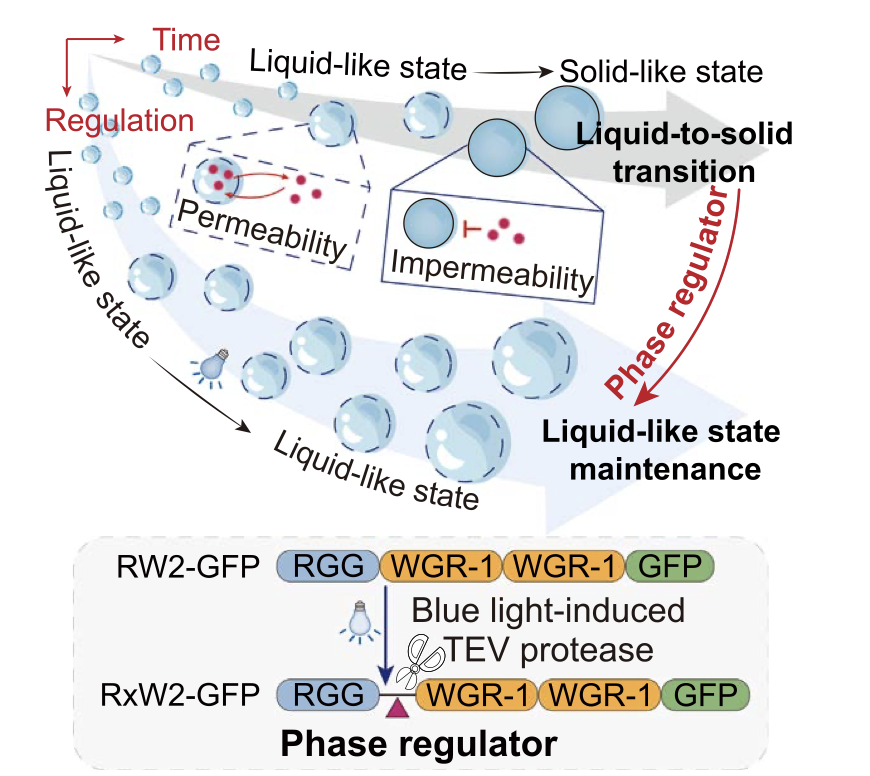
▲研究总括图
接下来,本喵将带你细致拆解这项工作中每一步的重要策略与思路。
🌱 研究背景
生物分子凝聚体(biomolecular condensates)近年来作为“无膜细胞器”的代表,在合成生物学和代谢工程领域引起了广泛关注。它们通常由天然无序蛋白(IDPs)或低复杂度序列蛋白等分子通过液-液相分离(LLPS)自组装形成。
这类凝聚体呈液滴状结构,具备独特的物理特性,如高分子浓缩能力、动态物质交换性、亚细胞定位特异性等,使其成为构建人工合成空间、调控代谢流和提高合成效率的理想平台。
与传统膜结构不同,生物分子凝聚体不依赖脂质膜包裹,而是通过多价弱相互作用维持动态组装,这使得它们能在细胞内快速响应环境变化,并精准调控代谢酶、底物或信号蛋白的空间聚集。
例如,在细胞内将多种相关酶局部富集到凝聚体中,可极大提升酶促反应速率,减少中间产物损耗,从而提高目标产物的合成效率。这一特性已被用于诸如萜类、黄酮类等天然产物的合成路径设计中,初步展现出广阔的应用潜力。
但问题也随之而来——在长时间发酵或高表达条件下,这些原本流动性良好的凝聚体结构常常发生不可逆的液-固相转变(liquid-to-solid transition),逐渐形成固态聚集物(solid-like aggregates)。
这种“凝聚体老化”现象不仅会导致底物和酶在结构中扩散受限,还可能降低酶活性、诱发细胞毒性甚至损伤细胞代谢稳态,从而严重影响代谢路径的持续运行与目标产物的累积量。
现有研究虽然在凝聚体的构建与酶招募方面取得了显著进展,但如何在动态发酵环境中维持凝聚体的“液态活性”,始终是一个亟待解决的技术难题。特别是在发酵中后期,凝聚体逐渐固化、功能衰退的问题,极大限制了其在工业化合成场景中的应用。
因此,开发一种可“按需”调控凝聚体流动性和相态的机制,已成为提升细胞工厂产能的关键突破口。
本研究正是基于这一挑战,提出并实现了一种可编程控制凝聚体固-液相转换的新型策略。通过将光诱导表达的蛋白酶系统嵌入到IDP结构中,实现了对凝聚体的“剪切解聚”调控,并以此维持其液态性质,从而打通从“结构材料工程”到“动态功能调控”的全链条应用路径。
研究内容
凝聚体的形成:RGG-(WGR-1)n架构赋予多样相态特性
在本研究中,作者通过构建融合蛋白 RGG-(WGR-1)n(n = 1, 2, 3),系统探讨了多价性(valency)对生物分子凝聚体形成与物理性质的影响。RGG结构域是一种典型的天然无序蛋白(IDP),本身相分离能力较弱。为增强其形成凝聚体的能力,研究人员引入了人工设计的短肽序列 WGR-1,并将其重复融合至RGG结构中。
实验发现,随着WGR-1重复次数的增加,蛋白由弥散分布逐步转变为形成可见的荧光颗粒,展现出良好的液-液相分离(LLPS)行为。
进一步的FRAP(荧光恢复)实验显示,RW2-GFP(n=2)形成的凝聚体具备较高的流动性(46.5%恢复率),表现出典型的液态特征;而RW3-GFP(n=3)凝聚体则几乎无恢复(3.4%),为固态聚集物。这些结果表明,WGR-1数量直接决定了凝聚体的相态。
此外,体外实验进一步验证了该趋势,并发现高拷贝WGR-1会导致蛋白表达水平下降,凝聚体更易沉淀于不溶性组分中。综上,作者通过精心设计的RGG-(WGR-1)n架构,明确建立了蛋白多价性、相变行为与凝聚体功能之间的定量关联,为后续凝聚体的可编程调控提供了坚实的理论与实验基础。
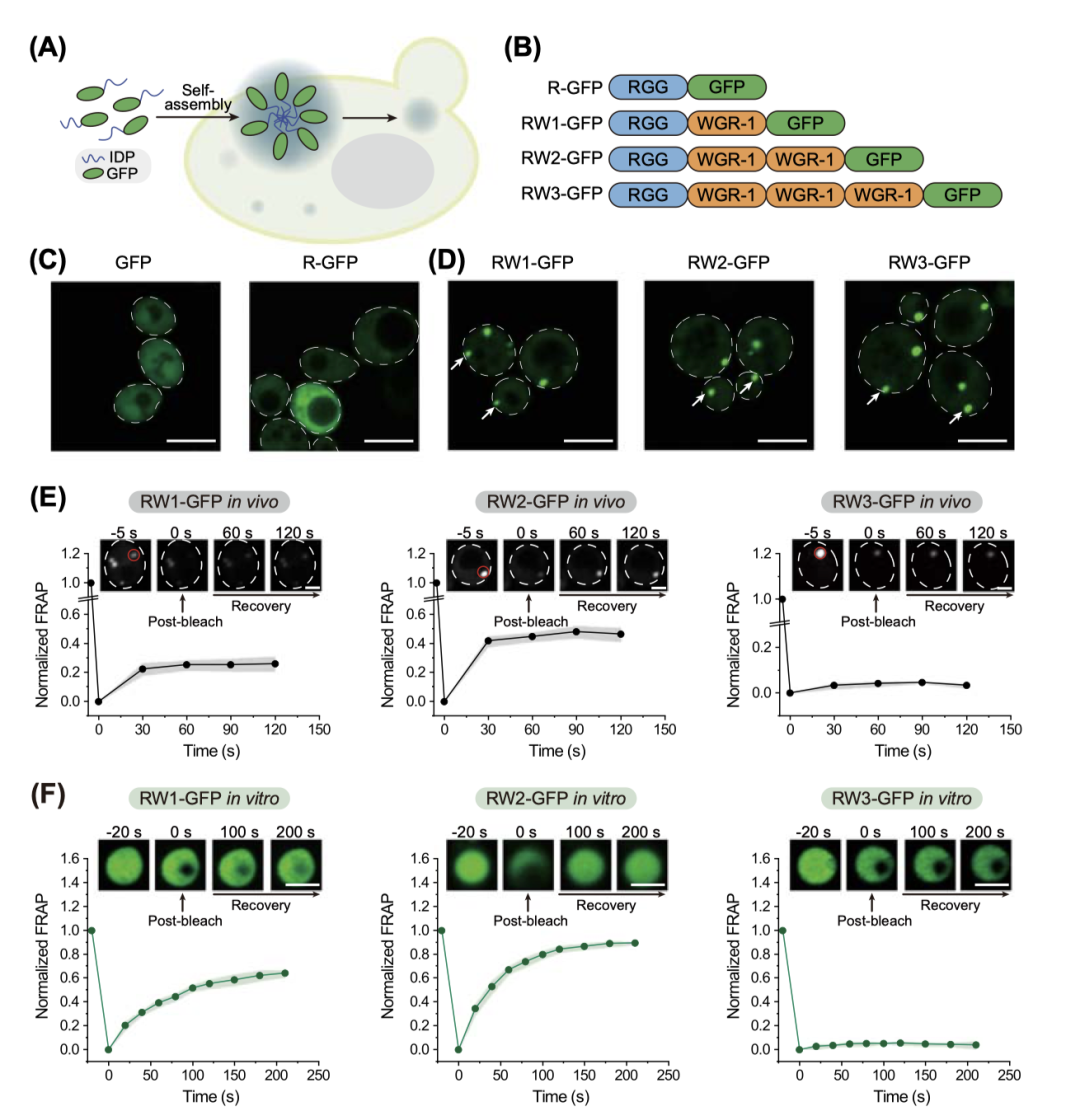
▲酿酒酵母中RGG-(WGR-1)n驱动的具有不同特性的凝聚体
RW2 凝聚体在发酵过程中的动态变化
构建出具备良好流动性的 RW2-GFP 凝聚体后,研究人员进一步追踪其在整个发酵过程(biosynthesis process)中的动态变化,发现这类凝聚体并非始终保持液态特性,而是随着时间推移发生了显著的物理性质改变。
通过 荧光恢复实验(FRAP),研究人员观察到,在诱导后 8 小时至 24 小时内,RW2-GFP 凝聚体保持较高的流动性,荧光恢复率维持在 45% 左右,展现出典型的液态状态。然而,进入 48 小时后,恢复率迅速下降至 17.5%,在 72 小时时更是接近 0%,这表明凝聚体发生了明显的液-固相转变(liquid-to-solid phase transition),逐步形成固态聚集物(solid-like aggregates)。
为进一步验证凝聚体是否“固化”,研究人员使用 1 M 尿素处理样品,结果显示早期(24 和 48 小时)形成的凝聚体在尿素作用下可以完全解散,而到了 72 小时,约 85% 的凝聚体仍保持完整,表现出明显的结构稳定性和抗干扰能力,这进一步佐证了其固态结构的形成。除了流动性下降,这一转变也带来了功能性削弱。
通过 小分子通透性测试,研究人员发现 RW2 凝聚体对 Cyanine5 染料的渗透性随着发酵时间显著下降,从 48 小时的 63.2% 降低至 96 小时的 13.5%。与此同时,RW2 对客户蛋白(client proteins)的招募能力也呈现下降趋势。在 24 小时时,RW2 能够成功招募约 83% 的 mCherry 和 CFP 蛋白,但在 72 小时后,这一比例分别下降至 52.2% 和 59.5%,表明凝聚体的功能特异性和动态组织能力随固化而显著减弱。进一步分析表明,这一现象的根本原因在于细胞内 RW2-GFP 蛋白浓度的持续升高。
通过 Western blot 和表达趋势拟合,研究人员发现 RW2-GFP 蛋白在发酵过程中呈指数型积累,且在 72 小时后完全转入不溶性状态,即使加入 8 M 尿素也无法重新溶解。这表明凝聚体的固化不仅是自然“老化”,更是由蛋白质浓度驱动的物理相变。
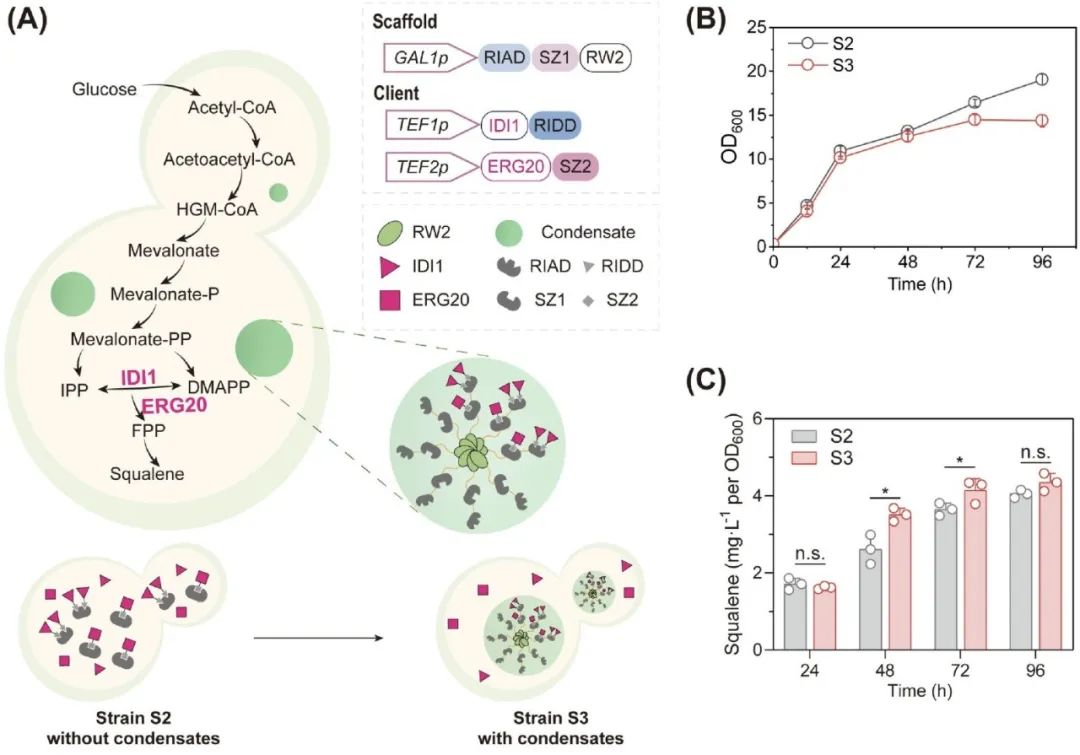
为了验证这一结构变化是否会影响代谢产物的合成效率,作者将 RW2 凝聚体应用于角鲨烯(squalene)合成路径中,通过短肽识别对 RIAD–RIDD 和 SZ1–SZ2 将关键酶 ERG20 和 IDI1 精准招募进凝聚体。
结果表明,在发酵 48 小时时,RW2 系统可将角鲨烯产量提升 34.5%,验证了其空间聚集能力对代谢效率的促进作用。然而,随着 RW2 凝聚体的固化,这一提升效果在 72 小时和 96 小时时分别下降至 13.7% 和 9.3%,说明凝聚体的“老化”会直接导致产物合成优势的丧失。
综上,本节不仅揭示了 RW2 凝聚体在发酵过程中的“结构–功能”演变过程,也明确指出:维持凝聚体的液态特性,是确保其代谢促进功能的关键前提。这为后续开发相态可控系统奠定了基础,也强调了凝聚体状态调控在合成生物学中的重要意义。
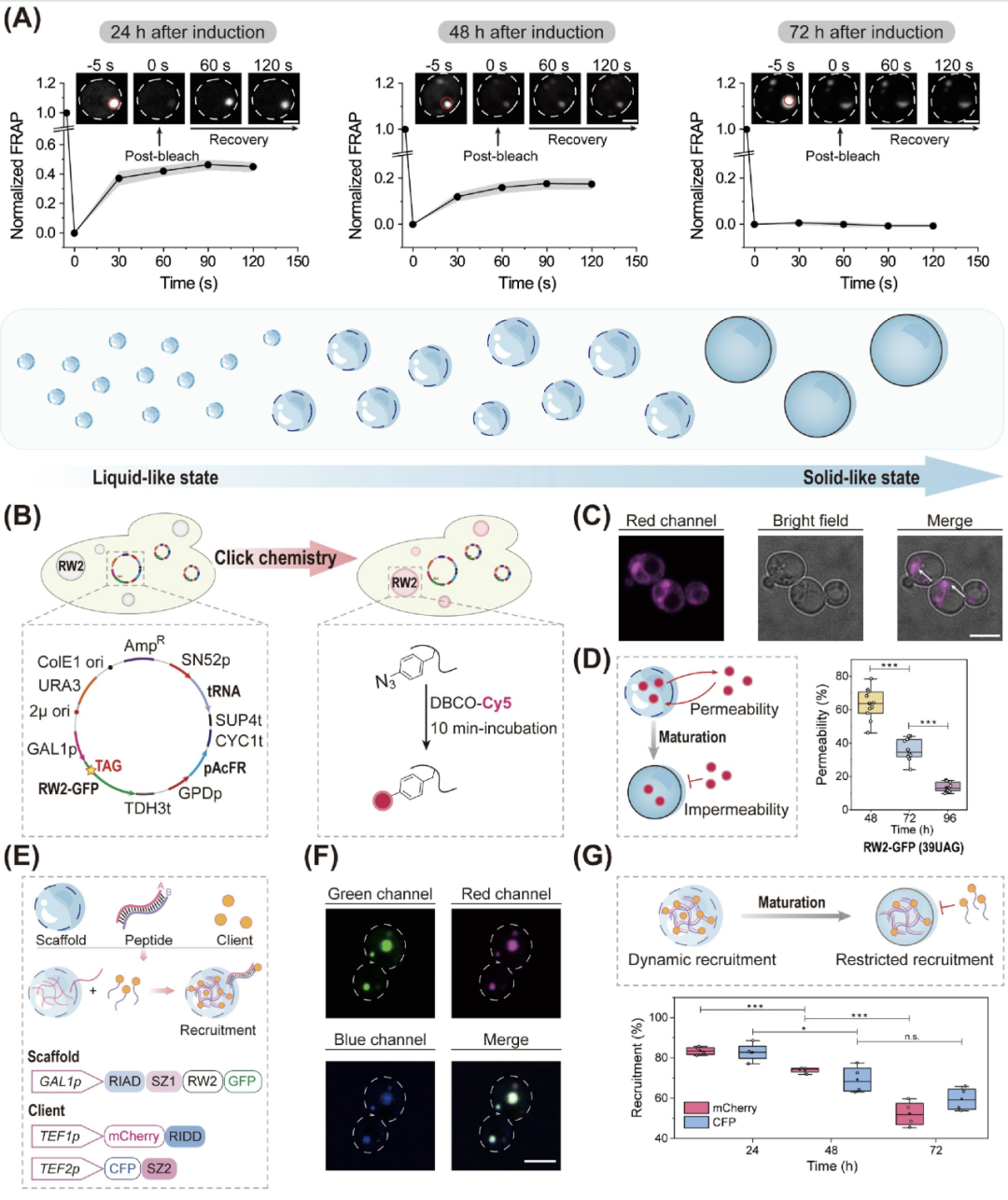
▲RW2 凝聚体在整个合成过程中的流动性、分子渗透性及客户蛋白招募能力分析
▲利用RW2凝聚体调节角鲨烯的生物合成
用于调控 RxW2 凝聚体流动性的光控相变调节系统
针对 RW2 凝聚体在发酵后期逐渐“固化”、流动性下降的问题,研究人员提出并构建了一种全新的 光控相态调节系统(light-controlled phase regulator),以实现对凝聚体物理状态的可编程调控(programmable fluidity)。
具体做法是在 RW2 蛋白结构中引入 TEV 蛋白酶识别序列,并通过蓝光诱导表达 TEV 蛋白酶(Tobacco Etch Virus protease),使其在特定时间剪切融合蛋白,从而降低多价性(valency)与蛋白浓度,调节凝聚体的聚集程度。该优化后的结构被命名为 RxW2-GFP。
在体外实验中,作者证明 TEV 酶可以有效切割 RxW2 蛋白并提高其流动性,FRAP 实验显示,处理后的凝聚体荧光恢复率从 48.4% 上升至 66.4%,验证了该策略的可行性。
随后,研究团队尝试在细胞内引入 不同强度的启动子以控制 TEV 酶表达,但发现普通启动子(如 PHSP104 或 PTEF1)要么表达过低无法调控凝聚体,要么表达过强导致凝聚体无法形成。
为此,他们引入了具备时间与强度可调性的 OptoQ-AMP 蓝光控制系统,该系统来源于 Neurospora crassa 的奎尼酸代谢调控网络,能够在蓝光照射下高效启动 TEV 酶表达,并具备较低泄漏表达。通过控制蓝光照射的时间和强度,研究者成功实现了对 RxW2 凝聚体流动性的动态调控。
例如,在 发酵 24 小时后开始蓝光照射 12 小时,即可显著延缓凝聚体成熟,48 小时时荧光恢复率维持在 42.8%,接近初始状态的 45.2%。若在 48 小时再补一次光照,流动性仍可一定程度恢复,尽管效果不如早期照射。这些结果表明:光控表达 TEV 蛋白酶可有效阻止或逆转凝聚体的固化进程,实现相态的可控转换与调节。
最终,作者通过连续两次蓝光照射(24h与48h),成功将 RxW2 凝聚体在发酵过程前 72 小时内维持在高流动性状态,为后续提升产物合成效率打下基础。
综上所述,该光控相变系统不仅展现出良好的可控性和响应性,还具备高时空分辨率、低背景、强适配性等特点,为微生物合成生物学中的空间组织调控提供了强有力的技术手段。
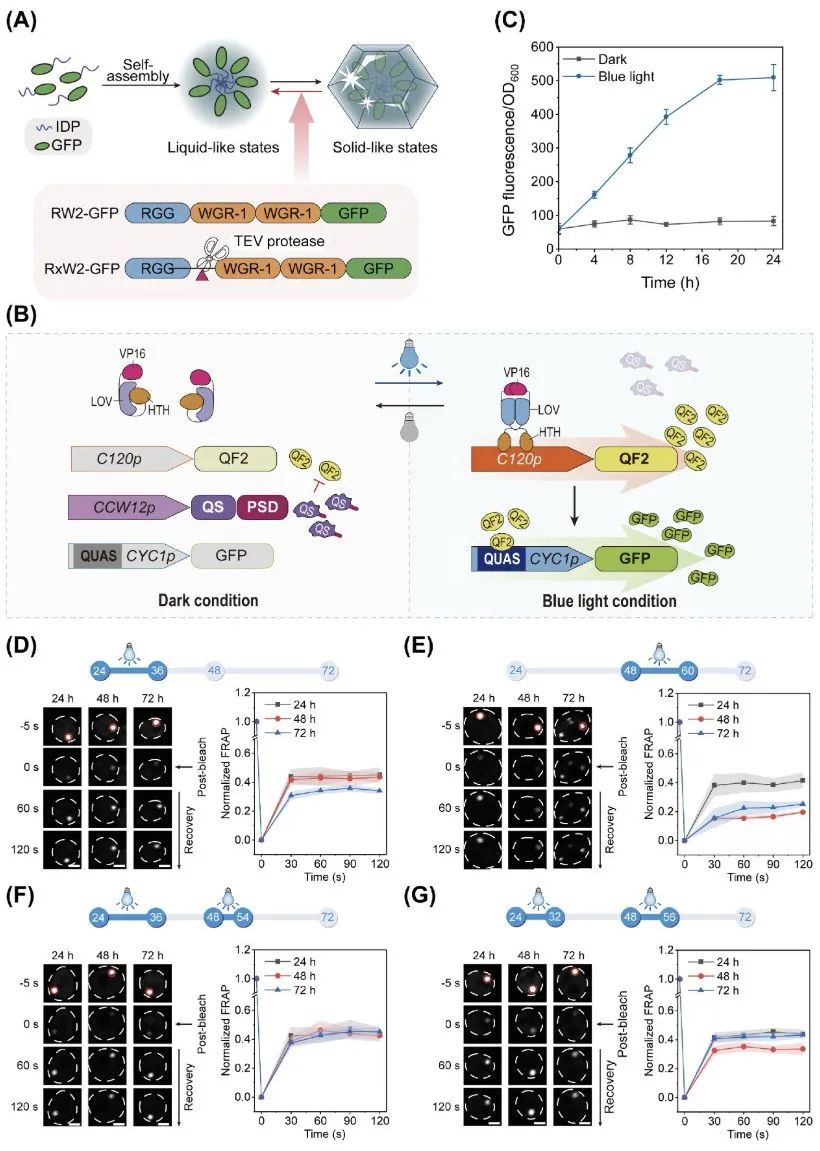
▲通过光控相变调节器实现 RxW2 凝聚体的可编程流动性
结合光控相变调节的 RxW2 凝聚体用于提升生物合成效率
在验证了光控相变系统可以有效延缓 RxW2 凝聚体的固化过程后,研究人员进一步评估了该策略在实际代谢产物合成中的提升效果。
首先,他们确认蓝光诱导本身对酿酒酵母的生长影响极小,且不会干扰角鲨烯或其他产物的正常合成,说明这一系统具备良好的生物相容性。
随后,作者将光控表达系统(OptoQ-AMP)与 RxW2 凝聚体结合,应用于角鲨烯合成菌株中。通过在发酵过程中设定特定时间点(如 48 h 和 72 h)进行蓝光照射以诱导 TEV 蛋白酶表达,成功实现了对 RxW2 凝聚体相态的时间控制。
结果显示,在加入光控调节系统后,菌株在 72 小时和 96 小时的角鲨烯产量分别提升 24.2% 和 32.4%,相比未照光的对照组具有显著优势。这表明光控剪切机制能够在关键阶段有效维持凝聚体的液态活性,从而持续促进代谢流动并提升产量。
除了内源产物角鲨烯外,研究人员还进一步将该系统拓展应用于三萜类化合物 熊果酸(ursolic acid) 的异源合成路径。通过将 UA 合成所需的三种酶(CrAS、CrAO、AtCPR1)招募至 RxW2 凝聚体中,并配合蓝光诱导调控相态,实验结果显示 UA 产量在 72 小时和 96 小时分别提高 39.5% 和 46.4%,增幅甚至高于角鲨烯,证明该策略不仅适用于内源代谢产物,也同样适用于复杂的异源合成网络。
综上,研究团队通过将 RxW2 凝聚体与蓝光诱导的相变调控系统相结合,实现了凝聚体功能状态与代谢产物合成效率的精准匹配,为合成生物学中“动态调控 + 空间组织”协同优化提供了有力示范,展示了广泛的可推广性与普适应用潜力。
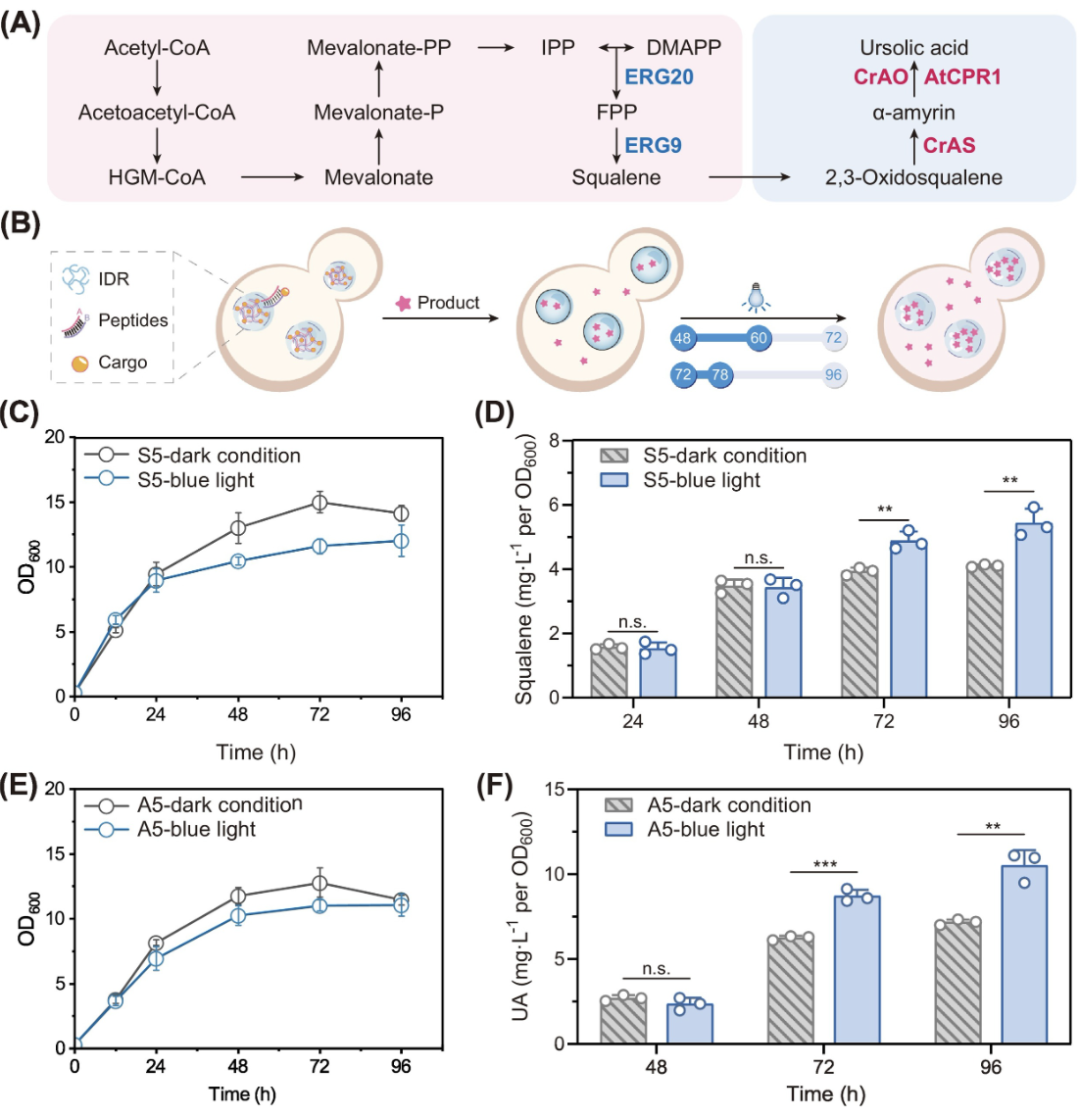
▲利用结合光控相变调节器的 RxW2 凝聚体调控角鲨烯和熊果酸(UA)合成
🔬 研究总结与展望
本研究围绕生物分子凝聚体(biomolecular condensates)在代谢工程中的应用展开,构建了基于 RGG-(WGR-1)n蛋白的人工凝聚体系统,并深入探讨了其在发酵过程中的相态演化与功能变化。
研究发现,虽然凝聚体在早期具有良好的流动性、渗透性和酶聚集能力,能够显著提升代谢效率,但随着时间推移,其逐渐固化,导致功能衰退,从而限制了代谢产物的持续合成。
为解决这一问题,研究团队创新性地引入了蓝光诱导的 TEV 蛋白酶剪切系统,构建了可编程的光控相变调节器(light-controlled phase regulator)。通过在特定时段对细胞进行蓝光照射,实现了对凝聚体流动性的动态调控,有效延缓其固化进程,并在酿酒酵母中成功应用于提升 角鲨烯(squalene) 和 熊果酸(UA) 的产量,分别提高了 32.4% 和 46.4%,展现出优异的应用潜力。
本工作不仅提供了一种可在时空尺度上精确操控凝聚体相态的新方法,也为实现“结构-功能-产量”一体化优化的细胞工厂提供了重要思路。
未来,该系统有望拓展至更多类型的代谢通路,甚至可与其他感应系统(如底物感应、氧化还原状态感应等)结合,实现更加智能化、自调节的合成生物模块。
此外,这项技术也为研究蛋白聚集相关疾病(如神经退行性病变)中凝聚体“液转固”机制提供了有力工具,具有潜在的跨学科价值。可以预见,随着工具的不断优化和适配宿主范围的扩大,光控凝聚体调控技术将在合成生物学、精准代谢工程乃至生物医学等多个领域发挥更加广泛的作用。
