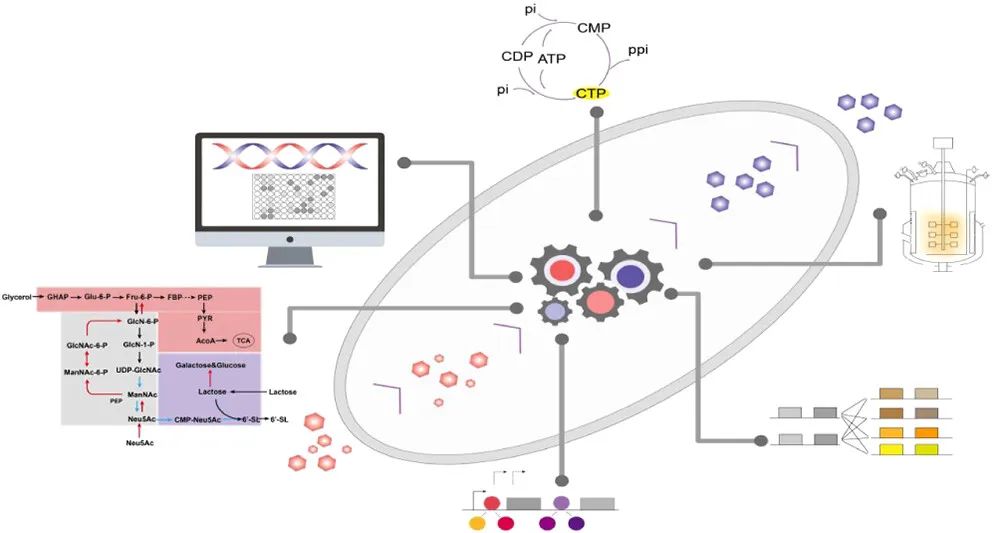
4月24日,江南大学糖化学与生物技术教育部重点实验室史劲松团队在Journal of Agricultural and Food Chemistry(IF: 5.7)上在线发表了题为《Enhanced Biosynthesis of 6′-Sialyllactose in Escherichia coli via Systematic Metabolic Engineering》的研究文章。该研究通过系统的代谢工程技术,在大肠杆菌K12 MG1655中实现了6′-SL的高效生物合成,最终在5 L发酵罐中,经过76小时培养,6′-SL产量达到12.82 g/L。下面我们对这篇文章整理解读,供大家参考。
构建初始6′-SL生产菌株:通过CRISPR-Cas9系统敲除竞争性代谢途径基因(nanATEK、nagAB和lacZ),并引入两个关键酶(CMP-Neu5Ac合成酶NmCSS和α2,6-唾液转移酶Pd2,6ST)。初步摇瓶发酵实验中,6′-SL产量达到了0.98 g/L。
筛选不同来源酶及优化质粒表达组合:利用NCBI数据库针对利用NmCSS和Pd2, 6ST酶序列进行序列同源性分析,筛选出具有潜在高催化活性的酶 (来自Neisseria meningitidis的CMP-Neu5Ac 合成酶 NeuA(EC 2.7.7.43)和Pd2, 6ST),并构建不同的质粒组合进行测试。通过筛选和优化,将6′-SL产量提升至1.26 g/L。
启动子和RBS组合的优化:通过系统评估不同启动子和RBS组合对基因表达强度的影响,6′-SL产量达到2.41 g/L。
基于深度突变扫描的酶设计与改造:利用DeMaSK工具对关键酶NeuA和Pd2, 6ST进行氨基酸保守模式和突变频率分析,筛选出潜在的有益突变位点,并进行实验验证。通过单突变和组合突变,NeuA突变体S185T-I194V将6′-SL产量提升至3.67 g/L,结合Pd2, 6ST突变体160T,6′-SL产量最终达到4.27 g/L。
构建CTP再生循环池:通过建立CTP-ATP循环再生系统,优化细胞内CTP供应,ppK和cmK的共表达使6′-SL产量达到4.92 g/L,并且提升了底物利用率。
5 L发酵罐放大实验:在5L发酵罐中进行补料批培养,严格控制发酵参数,如温度、溶解氧和pH值,并采用间歇补料策略维持最佳底物可用性,经过76小时培养,6′-SL产量达到12.82 g/L,相较于初始摇瓶培养(0.98 g/L)提升了13倍。此外,在系统菌株优化过程中的中间代谢物分析显示细胞内积累显著减少:ManNAc从亲本菌株(BC-CP)的2.83 g/L下降到组合突变体的1.13 g/L,而Neu5Ac水平从2.97 g/L下降到0.81 g/L。这些发现证明了通过迭代代谢工程逐步提高中间体利用效率。
通过上述一系列系统的代谢工程策略,研究团队在大肠杆菌中实现了6′-SL的高效生物合成,产量提升至12.82 g/L,取得了重大突破。这些成果不仅展示了代谢工程在生物合成领域的强大潜力,也为未来相关研究提供了宝贵的参考和借鉴。