
氧杂蒽酮类化合物是一类广泛存在于细菌,放线菌,真菌和植物体中的具有抗微生物,抗肿瘤,抗炎症,抗氧化等生物活性的天然产物。然而,氧杂蒽酮类天然产物在生物合成过程中蒽醌C4a-C10键酶促断裂的机理尚不清晰。在前期研究中,江南大学饶义剑教授团队报道了一种能够催化蒽醌C4a-C10键断裂的非典型非血红素铁依赖的双加氧酶BTG13(Angew. Chem. Int. Ed. 2022, 61, e202208772.)。晶体结构显示,BTG13具有罕见的四个组氨酸残基和一个羧化赖氨酸残基(Kcx)与亚铁离子形成的配位中心。由于该配位模式此前未被报导研究,因而Kcx在催化过程中的功能仍是未知,BTG13催化反应机理仍存在诸多疑团。为了进一步解析BTG13的催化机理,确定Kcx在反应过程中的功能,本研究通过使用分子对接,分子动力学模拟,量子化学计算,量子力学/分子力学(QM/MM)模拟等方法,详细解析了BTG13催化蒽醌C4a-C10键断裂的催化机理。研究结果表明,BTG13催化过程中涉及两步较为罕见的步骤:1)FeIII–O2•-对底物中sp3杂化碳原子上氢原子的抽取;2)O-O键均裂回弹并促使FeIII–OOH激活形成FeIV=O物种。此外,本研究还揭示了Kcx能够提高亚铁离子的供电子能力,从而促进氧气分子被亚铁离子活化形成FeIII–O2•-物种,并促进后续的氢原子抽取和O-O键均裂过程。因此,本研究不但为非血红素铁依赖型加氧酶的催化多样性提供了新的见解,而且为新型非血红素铁依赖型催化剂的设计提供了借鉴。
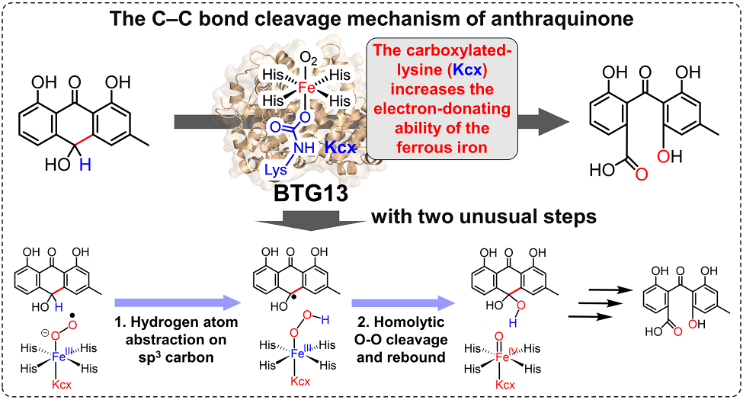
首先,本研究对BTG13可能采取的三种不同反应路径进行了推测(图1)。其中,从起始反应物((E•S•O2)I)到中间体IM2I为三条路径的共有过程,而从IM2I到IM3I则仅为路径I-a和路径I-c的共有过程。在中间体IM3I中,底物上的氧自由基进攻邻位苯环导致催化反应沿路径I-a进行;在中间体IM2I中,FeIV=O物种对苯环的进攻则导致催化反应沿路径I-b进行;在中间体IM3I中,底物上C4a-C10键均裂则导致催化反应沿路径I-c进行。
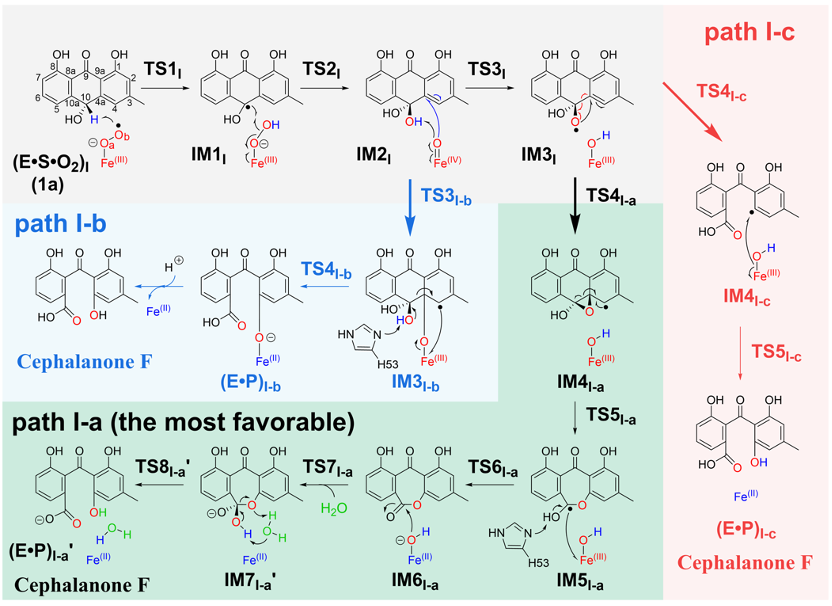
图1 三种可能的C-C键断裂催化机理
接下来,本研究对上述提到的三种不同的催化路径分别进行了研究。结果发现,路径I-a是最为可行的路径。通过对路径I-a的研究,表明反应决速步在FeIV=O的形成过程(IM1I到TS2I,能垒为19.1 kcal/mol,图1)。而在I-a路径的后半部分,反应过程中的最高能垒只有14.5 kcal/mol(IM2I到TS5I-a,图2)。综合研究结果发现,BTG13催化过程中涉及两步较为罕见的步骤:1)FeIII–O2•-对底物中sp3杂化碳原子上氢原子的抽取((E•S•O2)I到TS1I);2)O-O键均裂回弹并促使FeIII–OOH激活形成FeIV=O物种(IM1I到TS2I)(图1)。
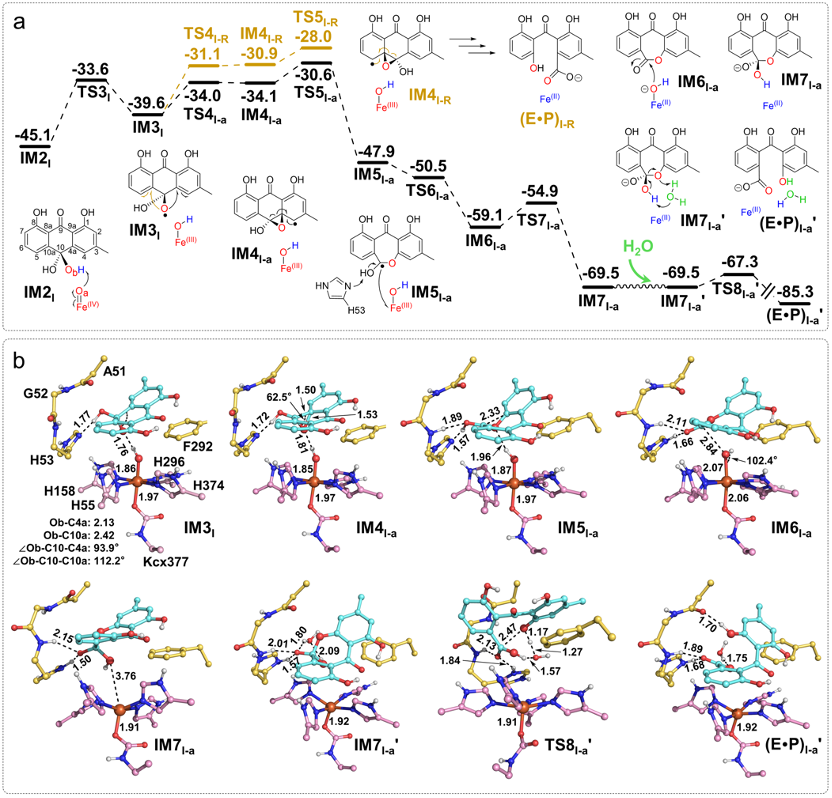
图2 对最可行反应路径I-a的研究
随后,为了进一步确定羧化赖氨酸在反应过程中的功能,本研究还探索了不同轴向配体对BTG13催化活性的影响(图3)。研究结果表明,未经过羧化的赖氨酸残基不能促使亚铁离子激活氧气分子,而羧化后的赖氨酸残基(Kcx)能够提高亚铁离子的供电子能力,从而促进亚铁离子激活氧气分子形成FeIII–O2•-物种,并促进后续的氢原子抽取和O-O键均裂过程。因此,本研究证明了Kcx对BTG13的催化活性有着决定性作用。
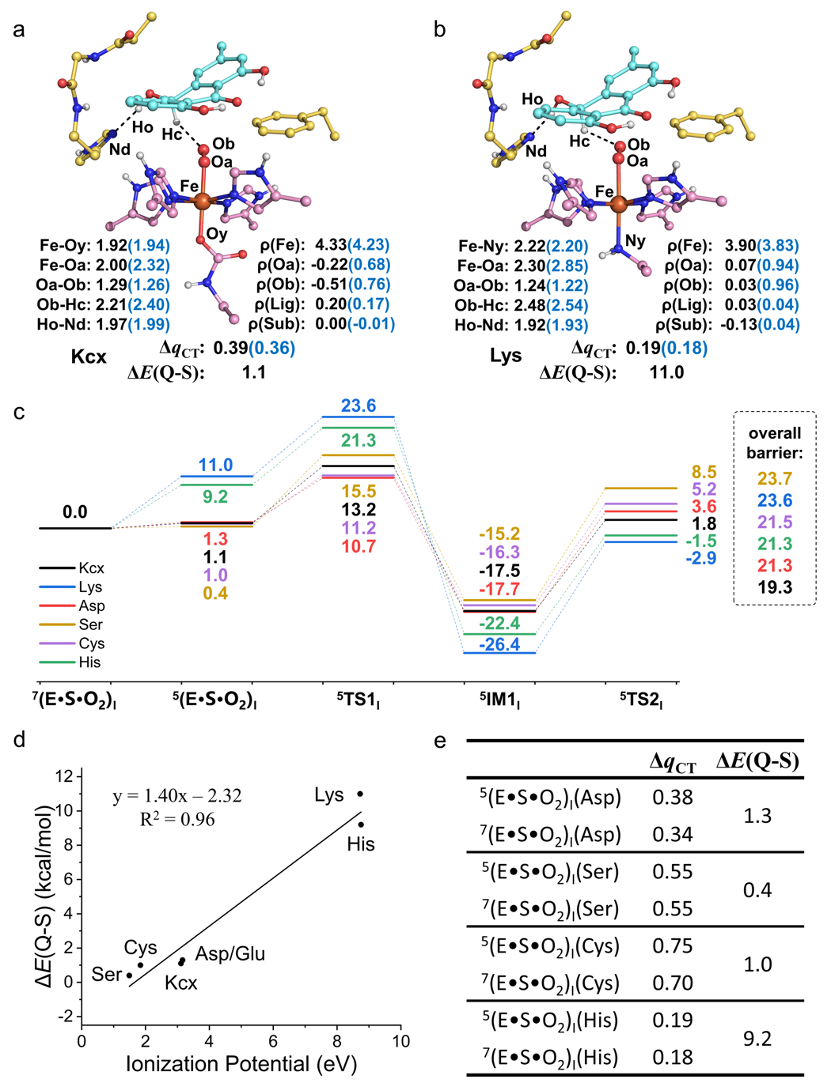
图3 不同轴向配体对BTG13催化活性的研究
上述工作被ACS Catal期刊在线发表,江南大学2021级博士生邓智威和中科院天工所苏浩副研究员为共同第一作者,江南大学糖化学与生物技术教育部重点实验室饶义剑教授和中科院天工所盛翔研究员为共同通讯作者。上述工作得到了国家重点研发计划(2018YFA0901700, 2021YFA0911500),国家自然科学基金(32270082, 22203102),江苏省自然科学基金(BK20202002)和天津市合成生物技术创新能力提升行动项目(TSBICIP-CXRC-063)等基金资助。
近年来饶义剑教授团队围绕“天然产物的途径解析和仿生定向合成与应用”开展了系统性的研究,并取得了一系列原创性研究成果,部分成果已发表在Nature Communications (2023,2024)、 Angew (2022, 2023)、 ACS Catalysis (2020,2021,2022,2024)、 Green Chemistry (2019, 2022)、 Water Research (2022)、 Journal of Hazardous Materials (2021, 2023)、 Chemical Engineering Journal (2021)等本领域权威期刊。
