2025年10月30日,糖化学与生物技术教育部重点实验室的Qi Liu和Yangyang Li等人在Bioresource Technology上发表了一篇题为Engineering a cyclic enzymatic cascade for efficient trehalose biosynthesis from maltodextrin substrates的研究性论文。

Abstract
海藻糖作为一种在自然界中广泛分布的非还原性二糖,因其稳定的化学特性和蛋白质保护功能,被广泛应用于医药、食品及化妆品领域。目前的工业级海藻糖生产依赖于麦芽寡糖海藻糖合成酶(TreY)与麦芽寡糖海藻糖海藻糖水解酶(TreZ)催化的两步酶促级联反应。然而,由于酶性能不足及短链麦芽寡糖作为不可转化副产物的积累,整体转化率始终未达理想状态。本研究采用计算机辅助酶工程技术,成功提升了来自 Arthrobacter ramosus 的TreY与TreZ的热稳定性及催化效率:TreZ突变体T212P热稳定性提高32.3%,而TreY突变体M1的热稳定性和催化活性分别提升至原始酶的2.97倍和0.63倍。为进一步提高底物利用率,通过计算筛选从 Corallococcus sp. EGB 中鉴定出高效4-α-葡聚糖转移酶(CSMalQ),该酶可催化短链麦芽寡糖的歧化反应,将其转化为可重新进入海藻糖合成途径的长链产物。通过将CSMalQ整合至酶系统,成功构建了以低成本麦芽糊精为底物的循环多酶级联体系,最终实现84.31%的海藻糖转化率,创当前最高纪录。本研究为海藻糖的生物合成提供了一条极具前景的新路径。
Introduction
海藻糖是由两个葡萄糖单元通过α-1,1-糖苷键连接形成的非还原性二糖,广泛存在于细菌、真菌及高等植物等多种生物界。在其三种立体异构构型中,α,α-型为自然界主要存在形式,而α,β-型与β,β-型则极为罕见。海藻糖的独特分子结构——两个吡喃葡萄糖环通过异头碳对称桥接——赋予其卓越的化学与热稳定性。这种结构稳定性及其保护生物大分子的能力,使海藻糖在食品、化妆品和制药领域展现出巨大应用潜力。
目前,酶催化转化是工业级海藻糖生产的主要方式,其催化策略主要分为两类。一类是使用海藻糖合酶将麦芽糖直接转化为海藻糖,但麦芽糖的高成本限制了该路线的经济可行性;另一类则采用麦芽寡糖海藻糖合成酶(MTSase)与麦芽寡糖海藻糖海藻糖水解酶(MTHase)的双酶系统,将直链淀粉逐步转化为海藻糖。在该过程中,MTSase首先切断直链淀粉还原端葡萄糖单元与相邻葡萄糖残基间的α-1,4-糖苷键,释放还原端葡萄糖,随后在剩余葡萄糖与下一糖单元间形成α-1,1-糖苷键,生成中间产物麦芽寡糖海藻糖;接着MTHase水解连接麦芽寡糖片段与海藻糖单元的α-1,4-糖苷键,最终获得海藻糖。在已报道的系统中,源自 Sulfolobus solfataricus KM1 的MTSase与MTHase构成了最高效的海藻糖生物合成催化组合,其转化率高达83.5%,为当前最高纪录,但仍未达到90.9%的理论最大值。与此同时,底物(尤其是纯化直链淀粉-17)的高生产成本进一步制约了其经济可行性。此外,近期开发的功能性糖联产工艺通过利用产赤藓糖醇细胞作为创新酶催化系统,为海藻糖合成提供了更具成本效益与环境友好性的生产方案。值得注意的是,根据Market Data Forecast(2024)数据,全球海藻糖市场规模在2024年已达2.5484亿美元,预计将以5%的年复合增长率持续增长,到2033年将达到3.9534亿美元。若能将转化效率提升10%,每年可通过降低原料与能耗成本节约1500–3000万美元,此类效率增益将直接改善生产经济性,并在持续扩张的市场中增强竞争力。
海藻糖生产效率受限主要归因于两大因素。首要挑战在于现有工业用酶在高温条件下的催化效率与热稳定性存在局限,导致底物转化不完全。尽管定向进化技术能获得改良酶变体,但需对大规模突变库进行繁琐筛选;而理性设计虽能基于构效关系的深入理解制定精准修饰策略,进而优化酶性能,但该方法高度依赖三维结构信息,且预测精度仍有待提升。近年来,机器学习技术的融入加速了理性设计的发展,但其成功率仍不理想,且需消耗大量计算资源与数据集。因此,结合理性设计与随机突变的半理性设计策略,已成为酶工程领域一种高效灵活的解决方案——该策略能快速筛选出符合工业级海藻糖生产严苛要求的优质酶变体。
此外,传统双酶法海藻糖合成体系中常出现短链麦芽寡糖(聚合度3–6)大量积累的现象。该问题源于MTSase与MTHase对这些中间产物的催化效率较低,最终导致总收率下降。既往研究表明,4-α-葡聚糖转移酶(4αGTs)对聚合度≥3的寡糖具有催化活性,能通过歧化反应将短链寡糖转化为更长链的产物。这些长链产物更适合作为MTSase与MTHase的底物,可被高效回收至海藻糖生物合成途径。然而截至目前,尚未有4αGTs成功提升海藻糖生产效率的报道。
本研究成功实现了来自 Arthrobacter ramosus 的MTSase与MTHase在大肠杆菌中的异源表达。为增强其热稳定性,采用计算策略提升分子刚性;进一步通过结构导向的理性设计,结合分子对接与预测算法鉴定了MTSase与MTHase的有益突变位点,并将这些优势突变组合获得热稳定性与酶活性同步提升的工程化变体。同时,通过本地化部署的DeepMolecules平台对来自不同微生物源的十种MalQ酶进行筛选,择定对麦芽寡糖预测催化效率最高的酶并于大肠杆菌中异源表达。最终,我们将优化的MTSase、MTHase变体与高性能MalQ酶组合,构建出高效的三酶级联系统,实现了海藻糖生物合成的协同催化。该体系较野生型酶组合的转化效率提升31.96%。整体而言,本策略为工业级海藻糖生产提供了具有广阔应用前景的解决方案。
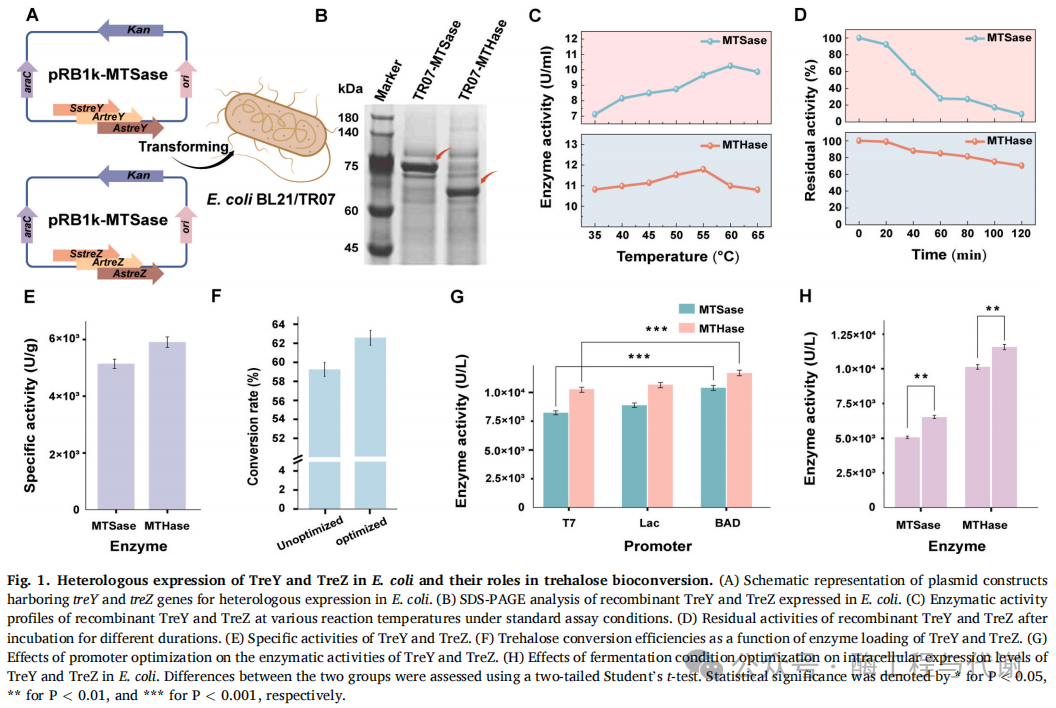
1. 基于麦芽糊精底物的海藻糖合酶异源表达
早期研究多采用源自 S. solfataricus KM1 的MTSase与MTHase,以纯化直链淀粉-17为底物进行海藻糖生物转化。然而纯化直链淀粉-17的高成本严重制约了该方法的实际应用。本研究选取了催化功能相同但来源不同的MTSase与MTHase,序列比对显示它们几乎无序列同源性。将这些基因对分别在大肠杆菌BL21和TR07中实现异源表达(图1A)。SDS-PAGE分析表明,源自 A. ramosus 的MTSase(TreY)与MTHase(TreZ)均呈现出与理论分子量一致的蛋白条带,证明其在大肠杆菌TR07中成功实现重组表达(图1B)。值得关注的是,这两种酶均来自嗜温菌(A. ramosus),而嗜热酶同源物的表达效果较差,这可能源于热稳定性与表达水平间的权衡效应。随后对含TreY与TreZ的发酵上清液进行纯化及酶学表征:TreY与TreZ的最适反应温度分别为60°C与55°C(图1C);60°C热稳定性检测显示TreY半衰期为34.65分钟,TreZ达269.86分钟,表明TreZ具有更优异的热稳定性(图1D);进一步测定60°C下的比活性,以麦芽六糖为底物时TreY为5130 U/g,以麦芽四糖海藻糖为底物时TreZ为5890 U/g(图1E)。据报道,S. solfataricus KM1来源MTSase与MTHase的比活性分别为10 U/g与2282 U/g。相较而言,本研究表征的酶展现出显著更高的活性,凸显出其在海藻糖生物转化中的巨大潜力。
将能同时产这两种酶的重组菌株共培养于以麦芽糊精为底物的反应体系中。考虑到其热稳定性及在高温下提升的催化效率,反应在60°C下进行16小时。在此条件下,体系实现了部分海藻糖转化,转化率达到59.3%(图1F)。进一步探究了不同细胞投加量对转化效率的影响:海藻糖产量随重组菌添加量增加而上升,当TreY生产菌与TreZ生产菌各添加12 OD600单位时达到平台期,最高转化率为62.5%(图1F)。这些结果表明,提高酶负载量可促进海藻糖合成,但超过一定阈值后,继续增加酶量无法进一步提升转化率。该平台效应可能源于单位生物量的酶浓度限制及酶自身催化特性,说明单纯增加酶总量对转化效率的提升作用有限。
为进一步提升海藻糖转化率,尝试通过优化表达元件增强TreY与TreZ的胞内表达水平。系统评估了三种启动子:一种组成型启动子(T7)和两种诱导型启动子(阿拉伯糖诱导型BAD与IPTG诱导型Lac)。其中,BAD启动子显著提升了两种酶的表达量,TreY与TreZ分别增加24.5%和15.9%(图1G)。尽管表达水平有所提高,宿主细胞内仍观察到大量包涵体形成。为改善蛋白可溶性及活性,进一步优化了发酵参数(包括温度、诱导剂浓度与诱导时机,详见补充材料),最终使TreY与TreZ的胞内酶活分别达到6.49 U/mL与11.65 U/mL(图1H)。将相同光密度的菌体添加至以麦芽糊精为底物的反应体系后,催化结果显示海藻糖转化率提升至67.8%(图1F)。虽然这一结果具有显著改善,但产量仍低于理论最大值。因此,后续工作应聚焦于对TreY与TreZ进行工程化改造,以优化其催化性能。
2. 提升TreY对麦芽六糖的催化性能
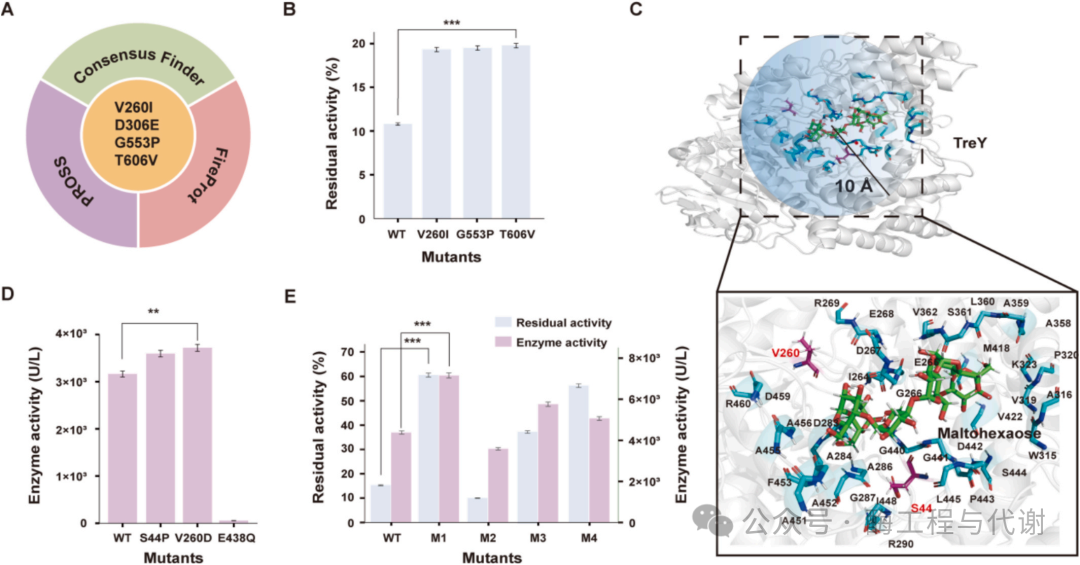
近期计算酶工程领域的突破性进展,为酶学特性的高效精准优化提供了全新可能。本研究采用多算法整合策略(Consensus Finder、PROSS与FireProt)预测TreY的稳定性突变位点(图2A)。其中,Consensus Finder基于进化保守性鉴定突变,旨在提升重组表达过程中的蛋白稳定性与可溶性;PROSS通过生成多重稳定化突变序列,应对异源系统中半衰期短与Tm值偏低等挑战;FireProt则整合多种预测工具与数据库注释,经由能量与进化双重筛选,在排除组合突变潜在拮抗效应的同时,精准选取具有稳定效应的单点突变。
在三种工具共同预测的四个潜在突变体(D306E、S361P、G553P与T606V)中,D306位点显示出高度保守性,其余三个突变被选取进行实验验证。经60°C一小时热稳定性测试,发现G553P与T606V两个突变体的稳定性显著提升。其中T606V突变体表现最为突出,其残余酶活较野生型提高83.3%;G553P突变体亦保持80.6%的活性增幅(图2B)。这些结果凸显了计算导向的酶工程策略在理性热稳定性改造中的有效性,为工业应用提供了强效候选酶。
为提升TreY的催化效率,采用分子对接技术模拟其与麦芽六糖的相互作用。首先通过Swiss-Model以 Arthrobacter ramosus 来源的TreY蛋白(PDB ID: 6LCU)为模板构建同源模型,同时运用AlphaFold 3进行结构预测。结构对比分析表明两种模型具有相当的准确性。利用Maestro获得最稳定的对接构象后,对配体10 Å半径内的氨基酸残基进行突变扫描(图2C)。根据Funclib的Total评分标准,较低分值代表突变体稳定性更高且可能提升催化效率。在八个推荐突变中,S44P、V260D与E438Q被一致优选,因此构建这些突变体进行实验验证。结果显示:V260D突变体的比活性较野生型提升17.4%;E438Q突变体则完全丧失催化活性,表明E438在酶功能中起关键作用;S44P突变体亦呈现适度改善,比活性增加13.8%(图2D)。
为同步提升TreY的热稳定性与对麦芽六糖的催化效率,以优势突变V260D为基础构建组合突变体。将该突变与先前鉴定的两个热稳定突变G553P和T606V进行组合,获得三个双突变体(M1: V260D/G553P;M2: V260D/T606V;M3: G553P/T606V)及一个三突变体(M4: V260D/G553P/T606V)。其中M1展现出最佳综合性能:相较于野生型,其催化活性提升0.63倍,60°C热稳定性增强2.97倍(图2E)。值得注意的是,三突变体M4未呈现叠加效应,而M2的活性与稳定性显著降低,暗示V260D与T606V间存在负上位性效应(图2E)——尽管二者在空间结构上相距较远。为深入优化T606位点,在M1背景上进行饱和突变,但所得变体均未超越M1的酶学性能。基于上述数据,最终确定M1为最具应用潜力的TreY优化变体。

3. M1突变体酶学性能提升的分子机制
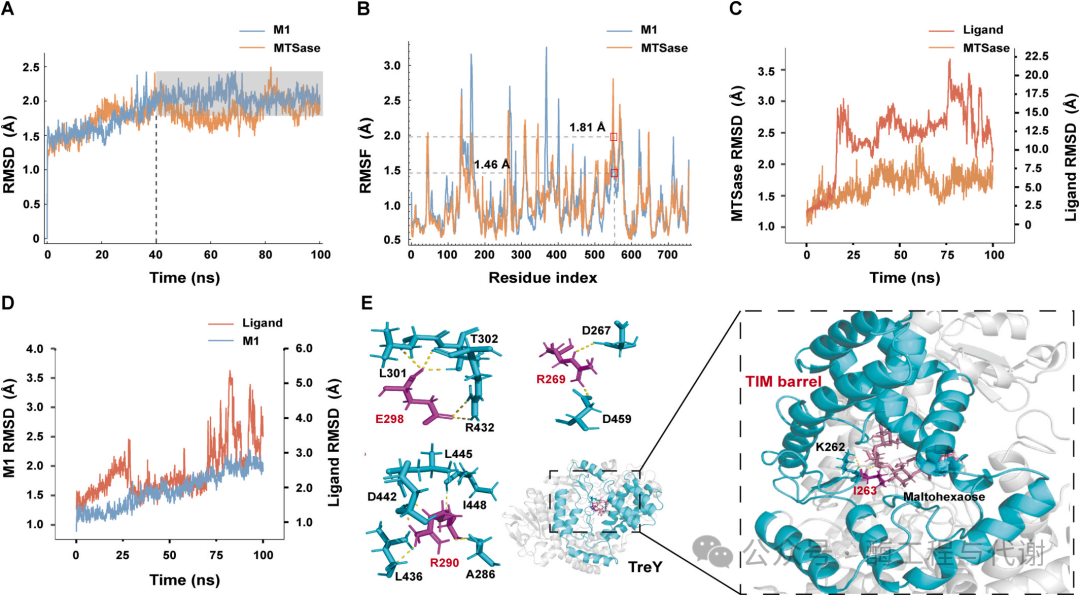
为阐明工程突变体M1热稳定性提升的结构基础,采用AlphaFold 3预测其三级结构,并通过SAVES v6.1进行验证。所得模型整体质量评分高达98.5314,其中91.55%的氨基酸残基获得≥0.1的3D-1D轮廓匹配分值。拉氏图分析显示90.2%残基位于最优允许区,9.6%位于额外允许区,仅0.2%位于禁止区,充分证实了结构模型的可靠性。
通过100 ns分子动力学模拟评估野生型TreY与突变体M1的动态稳定性。野生型酶持续出现RMSD波动且未达到构象平衡,而M1变体约在40 ns后实现结构平衡,体现出更高的结构刚性。具体而言,野生型TreY的平均RMSD为1.9 Å,M1则降至1.7 Å(图3A)。RMSF分析进一步显示突变位点存在局部稳定化现象:G553P取代导致区域柔性显著降低(RMSF = 1.46 Å,野生型为1.81 Å)(图3B),证实该区域成功实现刚性强化。相比之下,V260D位点仍保留野生型的柔性特征,表明其主要功能在于催化增强而非稳定性提升(图3B)。尽管在D220与I450残基附近检测到局部柔性增加,但G553P的主导稳定效应仍使整体热稳定性得以改善。从分子间相互作用视角分析,突变体M1较野生型净增6个范德华作用位点,这为其结构稳定性提供了重要支撑。
对野生型与M1突变体酶-底物复合物进行的比较分子动力学模拟(100 ns)显示二者结合稳定性存在显著差异。在野生型体系中,麦芽六糖早在18 ns即发生解离,表现为配体RMSD急剧上升(图3C);而在M1体系中底物可稳定结合长达70 ns(图3D),表明结合亲和力增强提升了酶-底物稳定性。酶与麦芽六糖相互作用力分析显示结合作用全局增强,具体表现为M1变体在I263、R269、R290和E298残基处形成了野生型中不存在的稳定氢键网络。值得注意的是,I263位于连接催化TIM桶结构的loop区(图3E),其稳定性对维持催化中心与底物的空间取向至关重要。这一扩展的相互作用网络不仅强化了底物结合亲和力,更可优化活性位点的几何构型,为M1突变体催化效率的提升提供了结构基础。

4. 提升TreZ对麦芽四糖海藻糖的催化性能
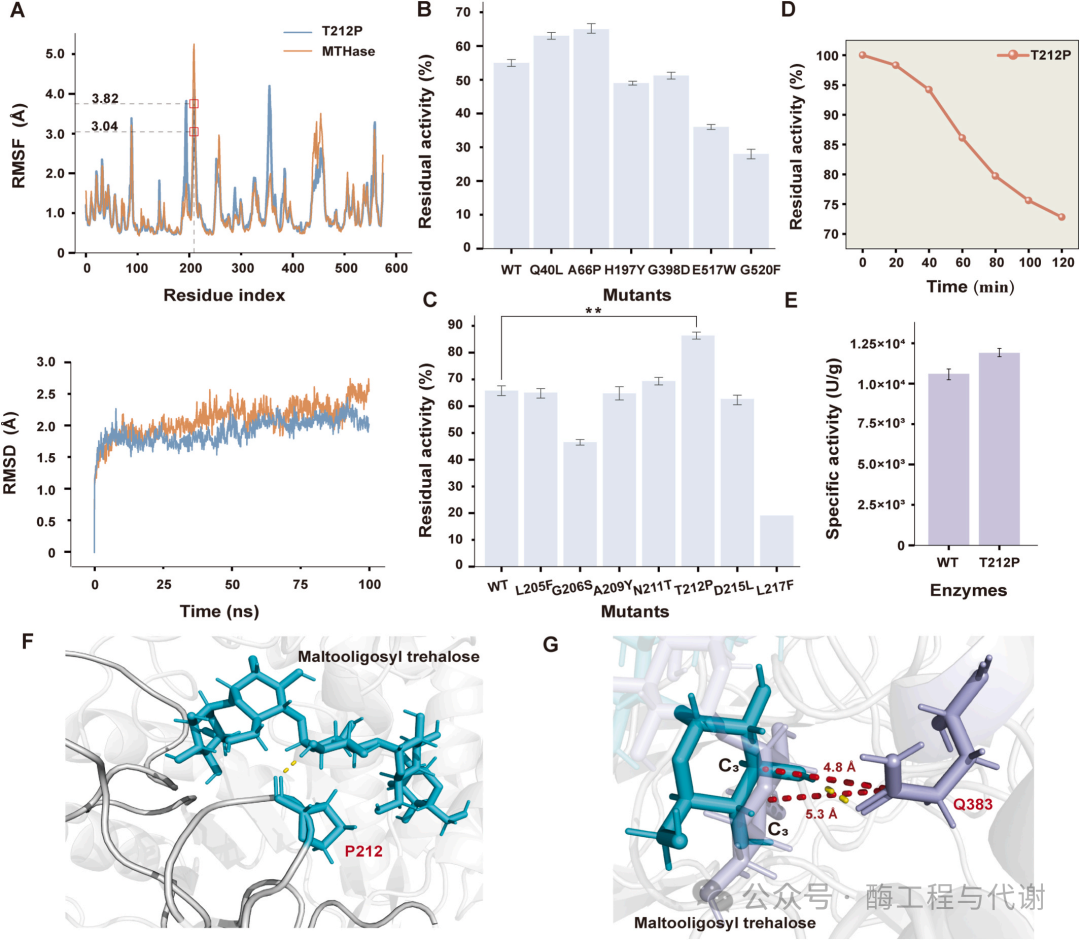
基于前期TreY的工程化策略,采用类似方法提升TreZ的热稳定性。然而,所有初始设计的变体均表现出较野生型更差的热稳定性。为此,通过AlphaFold 3预测TreZ的三级结构并进行100 ns分子动力学模拟(图4A)。RMSF分析鉴定出若干高柔性残基,从中选取位于柔性loop区的六个非保守位点(Q40、A66、H197、G398、E517和G520)进行突变筛选。通过虚拟饱和突变技术在这些位点鉴定出六个候选突变,经96孔板高通量筛选评估其热稳定性。结果显示,仅Q40L与A66P呈现适度改善,残余酶活分别提升14.5%与18%(图4B)。由此可见,后续理性设计应聚焦于对结构刚性具有更大影响的关键位点,从而有效提升TreZ的热稳定性。
通过全局序列比对发现,超嗜热古菌 S. solfataricus 来源的SsTreZ与嗜温TreZ具有37.1%的序列一致性。SsTreZ展现出卓越的热稳定性,其最适作用温度达75°C,因而可作为TreZ结构导向工程化的理想模板。为探究其热稳定机制,对SsTreZ与TreZ进行分子动力学模拟,重点分析二者的RMSF图谱(图4A)。基于此,选取了八个残基(L205F、G206S、A209Y、N211T、T212P、D215L、L217F和I369D)进行定点突变。这些残基均位于柔性loop区或溶剂暴露区域,尽管其RMSF值未必最高。
酶学表征显示,T212P变体的热稳定性显著增强:热处理后仍保持86%的活性,较野生型提升32.3%;其余变体仅呈现微弱改善(图4C)。后续对T212位点进行饱和突变未能获得更具稳定性的变体。总体而言,这些结果验证了基于结构洞察移植热稳定序列特征这一策略在提升TreZ热稳定性方面的有效性。
基于已鉴定的单点稳定突变Q40L、A66P与T212P,构建了组合突变体以评估热稳定性的叠加效应。通过构建三个双突变体(M5: Q40L/A66P;M6: Q40L/T212P;M7: A66P/T212P)与一个三突变体(M8: Q40L/A66P/T212P)并进行表征,发现双突变体催化活性与野生型相当,而三突变体(M8)的活性与稳定性显著降低。在双突变体中,M5展现出最佳热稳定性,较野生型提升18.1%,但仍低于单点突变T212P的增益效果(32.3%)。因此,T212P被确定为最优TreZ变体,其在60°C下半衰期达342.72分钟,且比活性高于野生型(图4D和E)。
为提升TreZ对麦芽四糖海藻糖的催化效率,通过AlphaFold 3预测其三级结构,并与麦芽三糖海藻糖进行分子对接。鉴定出配体5 Å范围内的多个潜在底物相互作用残基,进而利用Funclib算法对这些残基进行ΔΔG突变扫描,预测出八个潜在有益突变(H253Y、E287K、H315Y、H316Y、D382E、T415P、H436F和G448A)。然而实验验证表明,这些突变均未提升催化效率:其中五个突变(H253Y、E287K、H315Y、H316Y和D382E)显著削弱酶功能,证实它们在底物识别与催化中起关键作用。还尝试对底物入口与结合腔进行工程化改造,但结构建模显示活性位点位于宽敞的凹形口袋中,麦芽四糖海藻糖可无障碍进入,表明该区域的改造收益有限。因此,后续工程化应聚焦于优化底物取向与稳定过渡态,以提升催化效率。

5. TreZ热稳定性增强的机制解析
为阐明TreZ突变体热稳定性提升的结构基础,我们通过AlphaFold 3预测了T212P变体的三级结构,并对野生型与T212P结构进行100 ns分子动力学模拟。野生型酶与T212P变体均在20 ns内达到平衡且在整个模拟过程中保持相对稳定(图4A)。野生型酶的平均RMSD为2.1 Å并呈现适度波动,而T212P变体维持略低的平均RMSD(1.9 Å)且构象偏差减小,表明其结构稳定性得到改善。RMSF分析进一步显示T212P变体在突变位点的刚性增强(RMSF = 3.04 Å,野生型为3.82 Å)(图4A)。尽管在突变体残基180与360附近观察到RMSF值升高,这些波动并未影响蛋白质的整体结构稳定性。
相互作用分析表明,T212P突变体中的稳定作用接触总数高于野生型酶,这为其结构稳定性提升提供了支撑。值得注意的是,在底物与两个特定残基P212和Q383之间观测到新型氢键(图4F和G)。位于活性位点邻近loop区的P212与底物形成新氢键,可能增强了局部结构刚性(图4F);同时,Q383与底物形成的新氢键使底物C3原子基团与Q383侧链酰胺基团羰基碳的距离缩短0.5 Å(图4G)。这种缩短的相互作用可能促使底物相对于催化残基采取更有利的取向,从而助力催化效率提升。此外,组合突变体较单突变T212P表现出更低的结构稳定性。我们推测组合突变可能破坏了维持TreZ天然构象的关键稳定作用(如氢键、疏水堆积与盐桥),结构建模进一步显示这些突变位点聚集于构象敏感区域,其同时替换很可能引入不利的张力。
6. 通过异源表达4-α-葡聚糖转移酶实现短链麦芽寡糖的循环利用
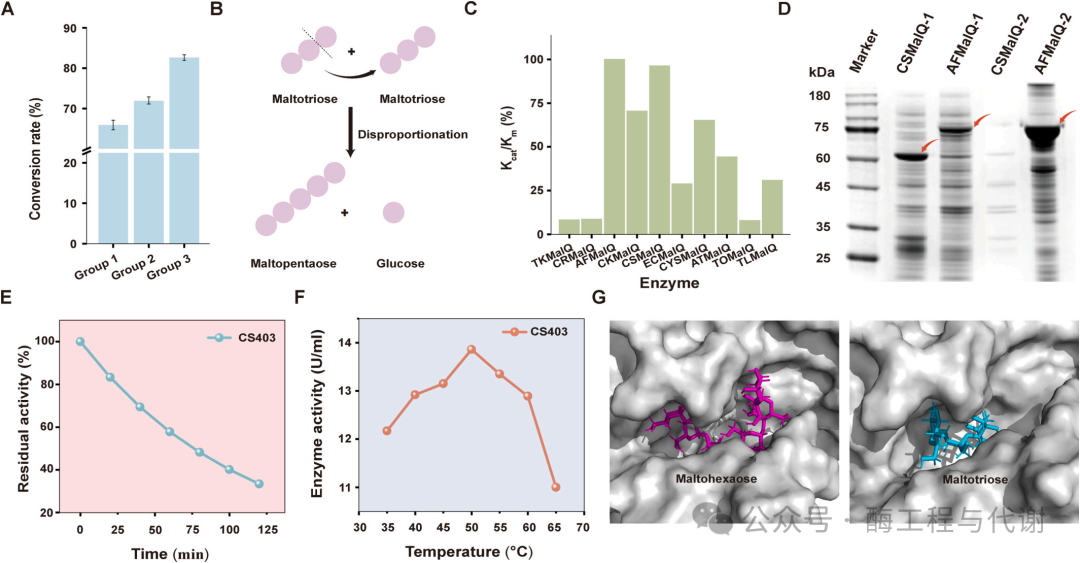
为评估两种工程化酶变体在海藻糖生物合成中的催化性能,将其用于麦芽糊精转化体系。该系统实现了71.9%的转化效率,较野生型酶提升6.04%(图5A)。然而,高效液相色谱分析显示多个非目标峰:根据前期研究,这些峰被鉴定为短链麦芽寡糖——它们是TreY/TreZ催化反应中生成的主要副产物。这些寡糖无法进一步转化为海藻糖,导致可利用底物大量损失,制约了整体转化效率。
为解决这一瓶颈,基于MalQ型4αGTs的歧化活性建立了副产物循环策略——该酶能将短链麦芽寡糖重新转化为长链底物(图5B)。通过数据库挖掘,从古菌(Thermococcus kodakarensis、Thermococcus litoralis 与 Archaeoglobus fulgidus)、真核生物(Capsella rubella 与 Arabidopsis thaliana)及原核生物(Cyanobacterium stanieri、Thermoleptolyngbya oregonensis、Citrobacter koseri、大肠杆菌与 Corallococcus sp. EGB)等不同进化来源中筛选出十种候选MalQ酶。基于DeepMolecules平台预测的催化效率(kcat/Km),选取两种酶(A. fulgidus 来源的AFMalQ与 Corallococcus sp. EGB来源的CSMalQ)进行深入研究(图5C)。值得注意的是,DeepMolecules平台的溶解度预测显示两种候选酶在大肠杆菌中的异源表达特征存在显著差异,这很可能反映了古菌与细菌蛋白在折叠需求上的本质区别——大肠杆菌可能缺乏协助古菌蛋白折叠的合适分子伴侣。鉴于其更优的表达水平与可溶性,CSMalQ被选用于后续酶系统的功能整合。
将CSMalQ基因克隆至表达载体pRB1K并在大肠杆菌TR07中表达。SDS-PAGE分析显示一条与预测分子量匹配的显著蛋白条带,证实可溶性CSMalQ(61.13 kDa)成功实现重组表达,而AFMalQ(76.89 kDa)则主要以包涵体形式存在(图5D)。酶学表征表明,CSMalQ最适作用温度为50°C,60°C下半衰期为79.52分钟(图5E和F),其催化特性完全适合整合至海藻糖生产工艺。同时,动力学参数测定显示CSMalQ与AFMalQ具有相当的动力学特性(表1),进一步验证了预测方法的准确性。将CSMalQ整合至TreY/TreZ催化体系后,色谱图中的次生峰被有效消除,整体海藻糖转化效率提升至82.63%。这些结果证实CSMalQ能高效将短链麦芽寡糖重新导向长链底物合成,通过创新的循环再生机制优化了海藻糖生产路径。尤为突出的是,该系统在整个过程中保持持续催化活性,实现了聚合度≥3的所有寡糖近乎完全的利用。
随后通过AlphaFold 3预测了CSMalQ的三级结构,并分别与麦芽三糖、麦芽六糖进行分子对接。CS4αGT的底物结合口袋主要由loop结构组成,其固有的柔性有利于不同尺寸底物的进出:较小的麦芽三糖可顺畅进入该通道,而较大的麦芽六糖可及性相对受限(图5G)。此外,CS4αGT与麦芽三糖、麦芽六糖均形成八个氢键,这些相互作用对稳定酶-底物复合物的催化构象至关重要,从而保障催化反应高效进行。基于此,提出通过工程化改造通道入口以适配麦芽六糖,有望进一步提升催化性能并最终提高海藻糖转化率。
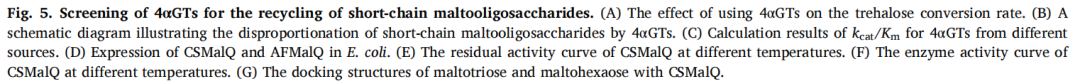
7. 在15升生物反应器中实现TreY、TreZ与CSMalQ的放大发酵
为探究三酶转化系统的工业化生产潜力,在15升生物反应器中分别对TreY、TreZ与CSMalQ进行放大发酵。其中TreY发酵呈现独特的生长特性:在初始0–14小时期间溶解氧(DO)水平快速下降,而OD600呈稳定线性增长且无明显指数期。葡萄糖在16小时耗尽(残余0.8 g/L),随即启动分批补料。当18小时OD600达44.3时,温度降至30°C并以L-阿拉伯糖诱导表达。发酵于46小时结束,最终OD600达125.2。这表明尽管存在非典型生长动力学特征,但仍成功实现了高密度培养(图6A)。
相比之下,TreZ发酵遵循更典型的动力学特征:指数生长期始于8小时,体现为溶解氧的急剧下降。但关键性葡萄糖限制事件发生于12小时(残余葡萄糖0.02 g/L),导致DO骤升至31.2%,后经葡萄糖补料及时修正。诱导在18小时启动(OD600 43.2)并同步降温至30°C,发酵于36小时结束,OD600达121.2(图6B)。该发酵曲线凸显了放大过程中精确监控葡萄糖浓度对避免代谢紊乱的重要性。
CSMalQ发酵展现了典型的微生物生长动力学:培养物于6小时进入指数期,伴随溶解氧特征性下降;12小时启动葡萄糖补料(残余葡萄糖0.49 g/L)以维持生长;18小时(OD600 41)诱导表达并降温至30°C后,培养物在40小时进入稳定期,最终OD600达118.7(图6C)。CSMalQ所呈现的稳定生长模式表明,该组分在海藻糖合成系统中尤其适合后续放大优化。
随后,将生物反应器发酵获得的TreY、TreZ与CSMalQ菌体应用于海藻糖生物合成。相较于摇瓶培养,放大工艺提升了酶产量,使海藻糖转化率达到84.31%(图6D)。这是迄今报道的以麦芽糊精——这一可显著降低总生产成本的经济型底物——为原料实现的最高转化率。该成果不仅彰显了多酶协同催化与半理性蛋白设计在酶工程中整合应用的技术先进性与实践价值,更为海藻糖的工业生物制造建立了全新范式。通过大幅降低底物消耗与能耗需求,该集成策略在提升经济可行性的同时促进了生产可持续性,从而为推进海藻糖产业向更高效率、更低能耗与环境友好型发展提供了重要实践价值。
基于当前成果,未来研究应着力突破现存瓶颈,推动工艺效率逼近理论极限。首先,尽管麦芽糖积累问题已得到缓解,但其完全消除仍是挑战。通过海藻糖合酶的定向进化与从头设计以最小化麦芽糖副产物生成,是极具前景的研究方向。其次,副产物葡萄糖是宝贵的碳源而非废弃物,其高效利用对提升全流程经济性与可持续性至关重要。借助先进的酶工程与合成生物学工具,不仅有望实现近乎完全的底物转化,更能推动海藻糖生产向零废弃、低成本的生物精炼模式演进。

总结
以往针对TreY/TreZ的酶工程改造通常仅聚焦热稳定性或催化活性单一维度,且一者的提升往往以另一者受损为代价。本研究通过独立优化分别增强两种特性的突变位点,继而组合有益变体实现热稳定性与催化效率的协同增益。针对催化过程中麦芽寡糖积累的难题,我们引入CSMalQ构建了具备高效底物循环能力的三酶级联体系,显著提升了底物利用率。该集成策略实现了84.31%的海藻糖转化率新纪录,标志着酶工程领域的重要进展,并为工业级海藻糖生物合成提供了坚实的技术支撑。
