近日,Synthetic and Systems Biotechnology在线发表了江南大学糖化学与生物技术教育部重点实验室刘龙教授课题组的研究成果“Expression and antimicrobial activity of the recombinant bovine lactoferricin in Pichia pastoris”(Lv et al., Synthetic and Systems Biotechnology. 2024, 9: 26–32)。江南大学吕雪芹副研究员为论文第一作者,刘龙教授为论文通讯作者。抗菌肽(Antimicrobial peptides, AMPs)是一种对细菌和真菌具有广谱抗菌活性的小肽,广泛存在于细菌、真菌、昆虫、高等植物、哺乳动物等生物中。由于无药物残留和耐药性等问题,AMPs常被用作抗氧化剂、食品添加剂和免疫强化剂等。乳铁蛋白抑菌肽是较为典型的一类AMPs,是乳铁蛋白在蛋白水解酶的作用下产生的功能性肽,其抗菌活性是全长乳铁蛋白的200-400倍。常见的乳铁蛋白抑菌肽包括LF1-11、lactoferrampin和lactoferricin,其中lactoferricin是一种具有25个残基的多功能肽,位于乳铁蛋白中第17-41号氨基酸残基,牛源lactoferricin (LFcinB)具有丰富的碱性和疏水氨基酸,且净正电荷数为8。该研究选用pPICZɑA质粒对lactoferricin进行重组表达,结合启动子和宿主细胞筛选,发现使用PAOX1启动子在毕赤酵母X-33中可以实现lactoferricin较高水平的重组表达,产量为19.5 mg/L。为提高lactoferricin的分泌量,进一步对信号肽进行了筛选,并将筛选出的较优信号肽分别与α-factor分泌信号肽进行杂交,结合表达量检测,获取了一条杂合信号肽0030-α,该信号肽可以明显提高lactoferricin的胞外分泌量,达到28.8 mg/L。研究过程中发现,随着lactoferricin表达量的提高,菌株生长被抑制的程度逐渐增加。考虑到不少AMPs的抗菌活性与净正电荷数呈正相关,而lactoferricin具有8个净正电荷,因此,为了减弱lactoferricin对宿主细胞的抑制作用,尝试了将净负电荷数分别为5和3的两个阴离子抗氧化肽PEP1、PEP2与lactoferricin进行单独融合和共融合,结果发现PEP1和PEP2与lactoferricin共融合的产量最高,3-L发酵罐中达到193.6 mg/L。最后,该研究还分析了lactoferricin的抑菌效果,发现重组表达的lactoferricin对大肠杆菌、枯草芽孢杆菌和金黄色葡萄球菌均具有较好的抑菌作用。上述研究得到了国家自然科学基金(32021005, 32270096)和中央高校基本科研专项资金(JUSRP222007, JUSRP622004)等项目的资助。
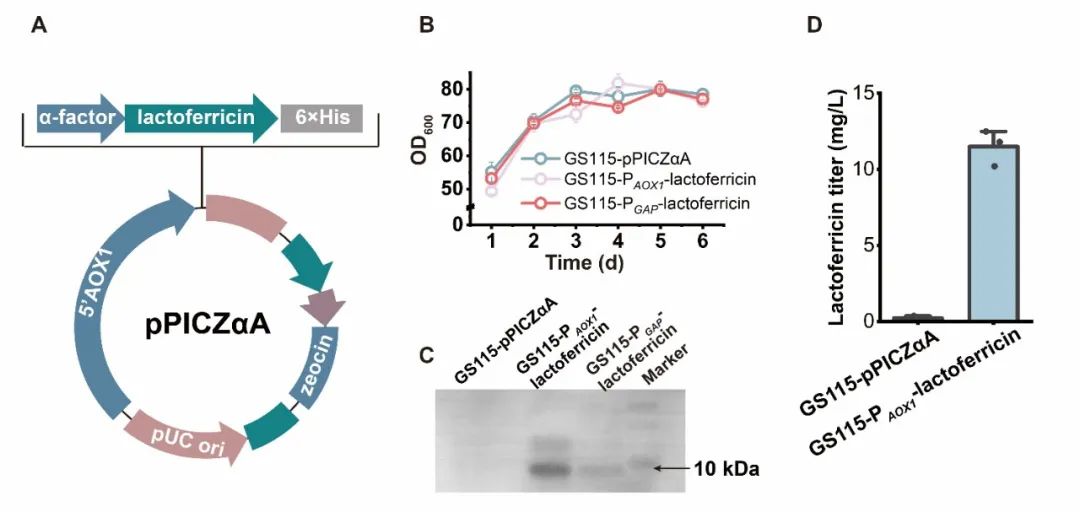
图1 毕赤酵母中lactoferricin的重组表达和启动子筛选
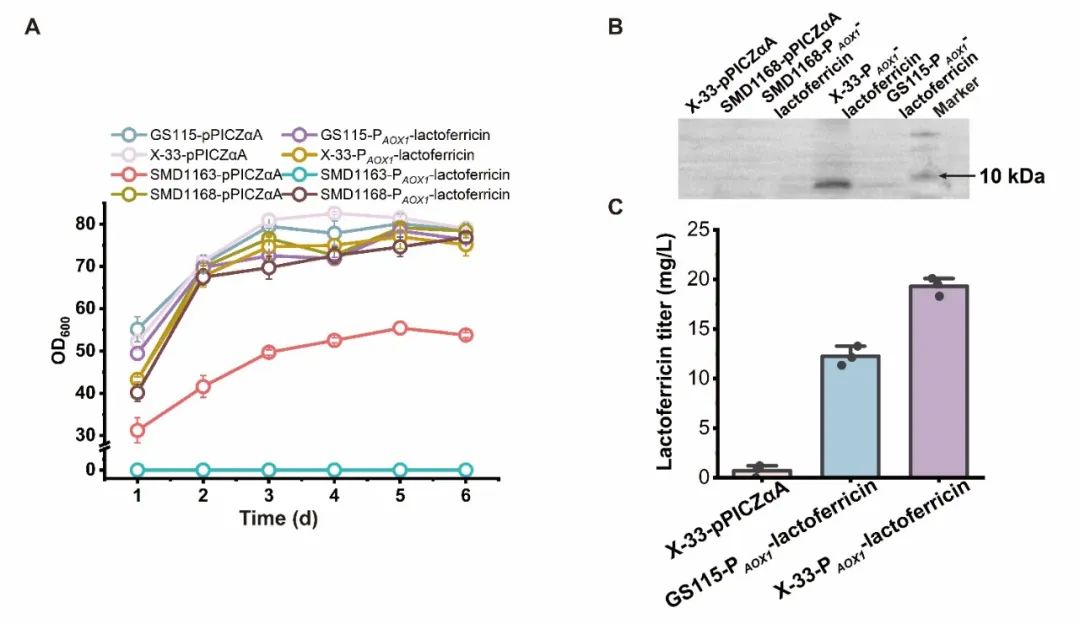
图2 宿主细胞筛选促进lactoferricin表达
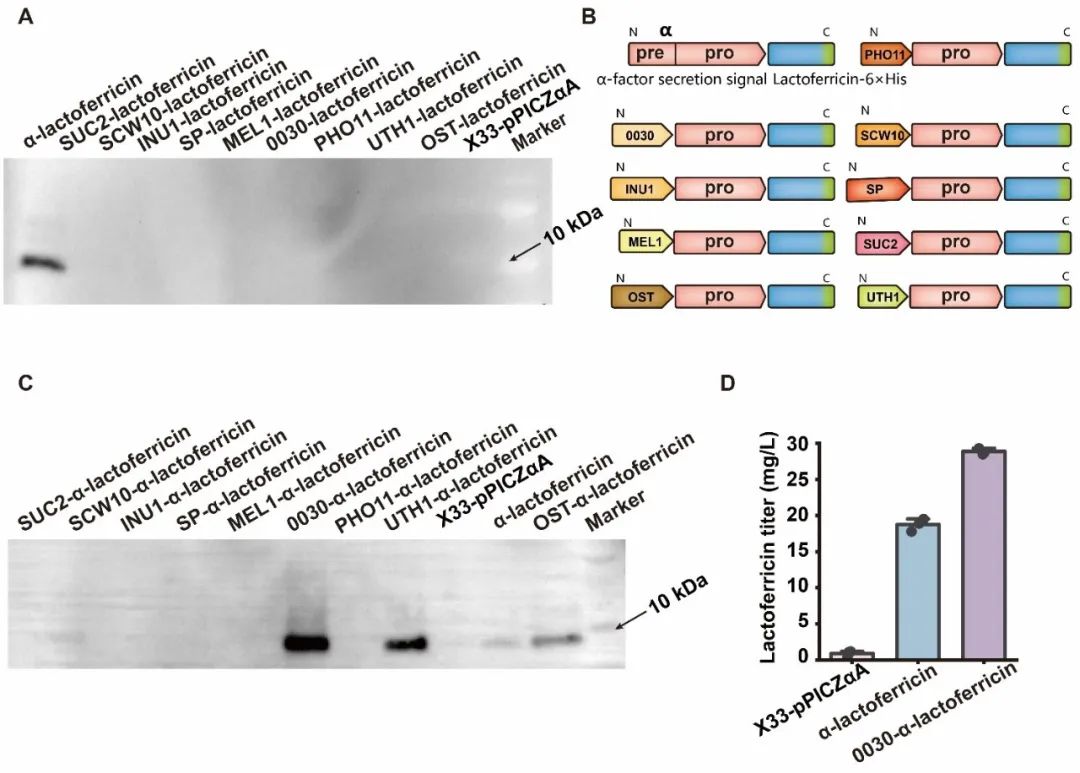
图3 lactoferricin分泌信号肽筛选
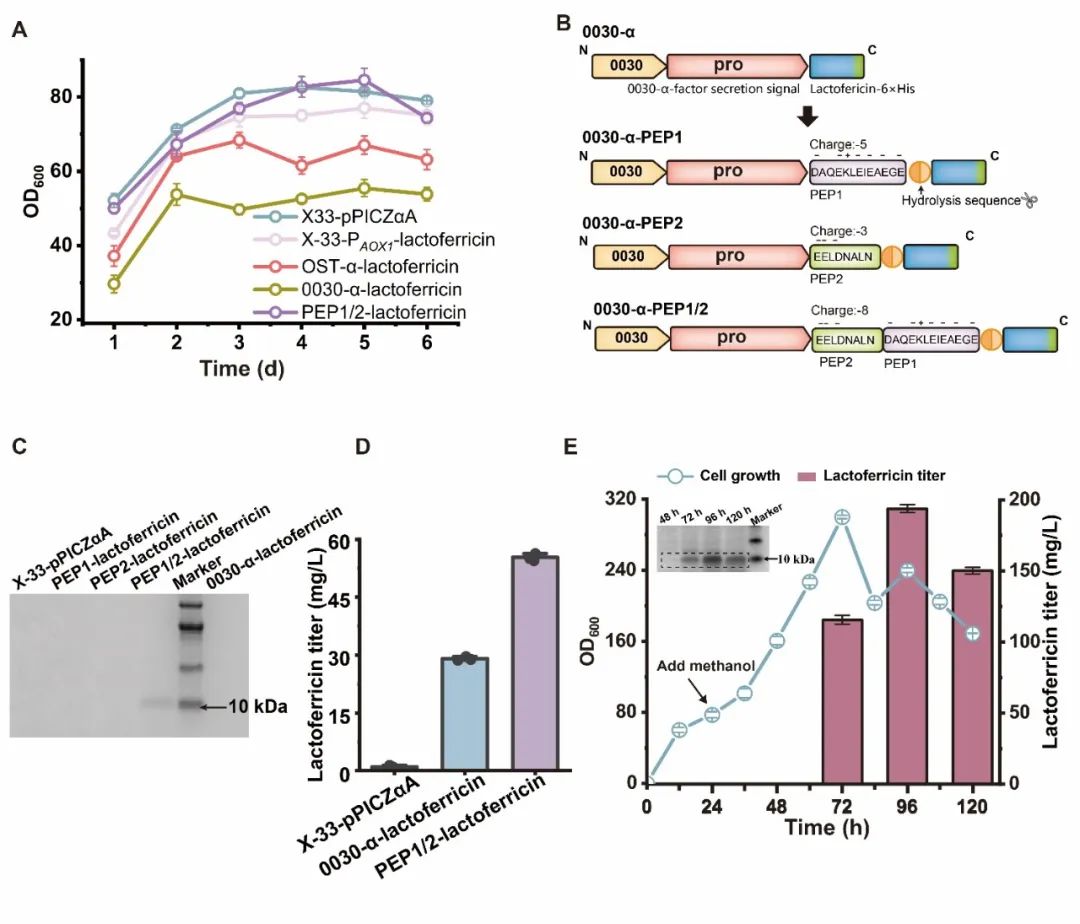
图4 阴离子抗氧化肽的融合促进lactoferricin的重组表达
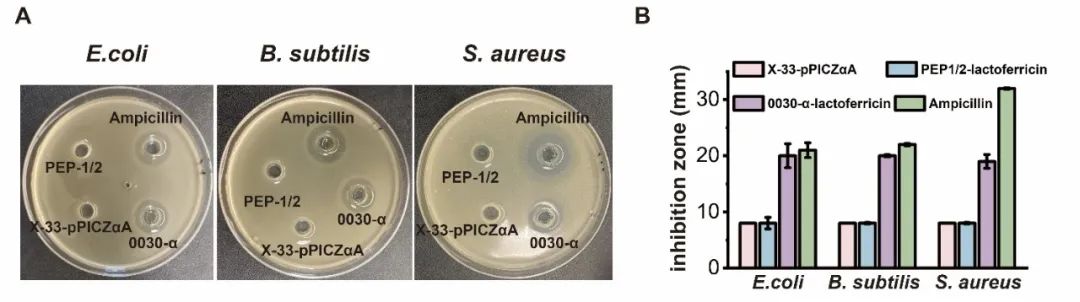
图5 重组lactoferricin的抑菌活性分析
