随着酶工程和合成生物学技术的发展,可再生原料能够通过生物催化或微生物细胞工厂转化为增值化学品。但由于酶的稳定性、催化效率和选择性不足,无法满足工业生物催化的要求。定向进化是近年来发展起来的一种强有力的工具,可以指导蛋白质进化,提高代谢途径的合成效率和性能。然而,传统的定向进化方法依赖于人工操作进行逐轮筛选,这些劳动密集型的工作极大地限制了进化的效率、规模以及深度。最近,生物体内的连续进化受到人们的广泛关注,通过模拟实验室中漫长的进化过程,能够快速实现体内多样化,从而可以在减少人为干预的情况下探索更广阔的序列空间。2024年1月22日,重点实验室的堵国成和江南大学未来食品中心的张国强教授在《Biotechnology for Biofuels and Bioproducts》杂志发表了题为“Ultrahigh-throughput screening-assisted in vivo directed evolution for enzyme engineering”的研究论文,该团队基于工程热响应抑制因子cI857调节的易错DNA聚合酶表达,以及具有温度敏感缺陷的基因组MutS突变体,开发了一个具有热敏诱导可调性的超高通量体内连续定向进化平台,用于固定大肠杆菌中的突变。该团队成功实现了以β-内酰胺酶为模型的体内进化,靶向突变率增加了约600倍。同时,结合超高通量筛选方法,成功应用于进化α-淀粉酶和白藜芦醇生物合成途径,因此可用于酶和生物合成途径的快速进化。
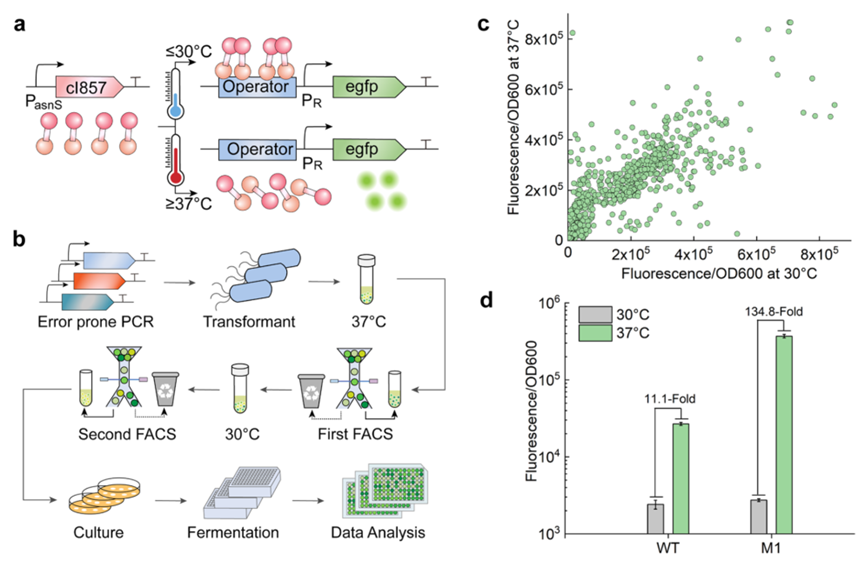
图1.高度热敏抑制因子cI857的定向进化
为了实现突变体PoL I的高效开关,研究人员首先对cI857进行定向进化,并通过荧光分选筛选出温度敏感性更高、低泄漏的突变体。为了减少抑制温度下的表达泄漏,进行第二轮FACS,从30°C培养的收集细胞中分类出大约5000个荧光较低的细胞。最后,选择768株进行荧光检测,以野生型菌株作为对照菌株。在30°C时,M1菌株的抑制效果和野生型基本一致,然而在37°C时,感应效应在3 h, 6 h和9 h大大提高。因此,在相同的诱导温度下,cI857*的蛋白表达量显著增加,可以作为一种更有效的温控外源蛋白表达体系。
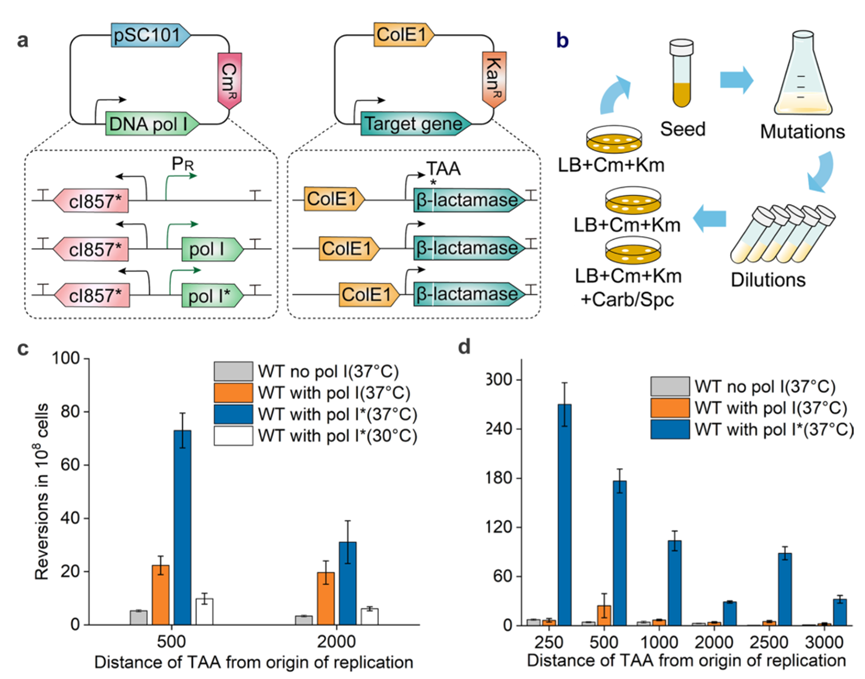
图2.基于大肠杆菌DNA Pol I的温控体内进化以及表征
为了建立一个温控的体内进化系统,研究人员在大肠杆菌BL21 (DE3)中构建了基于Pol I*的双质粒系统。同时,靶向突变率可以通过耐卡贝尼西林菌落的频率来量化。值得注意的是,带有Pol I*质粒的野生型菌株在距离ColE1位点250 bp处表现出最高的逆转率,大约是带有Pol I质粒菌株的41倍。随着与复制原点距离的增加,逆转频率急剧下降,但有效地在至少1 kb内产生突变。结果表明,与复制原点的距离影响突变率,与先前的报道一致。
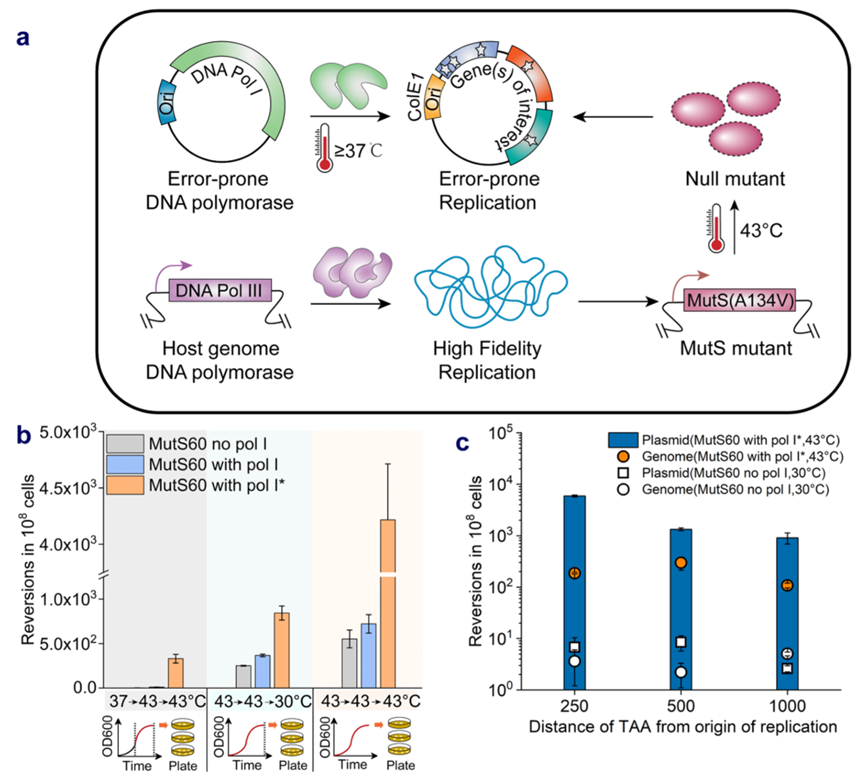
图3.基因组mutS的修饰提高质粒突变率
DNA错配修复(MMR)系统致力于检查新复制的DNA链中的错误,维持宿主基因组中相对较低的突变率。在大肠杆菌的错配修复系统中,mutS识别碱基错配,由MutL招募的MutH与MutS相互作用后切割相应的链。为了进一步提高靶质粒的突变率,研究人员对MMR系统进行了修饰,将mutS A134V突变引入BL21 (DE3)中,获得了对温度敏感的mutS突变MutS60。同时,研究了温度对靶向诱变的影响,当诱变温度保持在43℃时,携带Pol I*基因的MutS60菌株的质粒突变率最佳。结果表明,在诱变过程中,大肠杆菌基因组的突变率提高了约70倍。
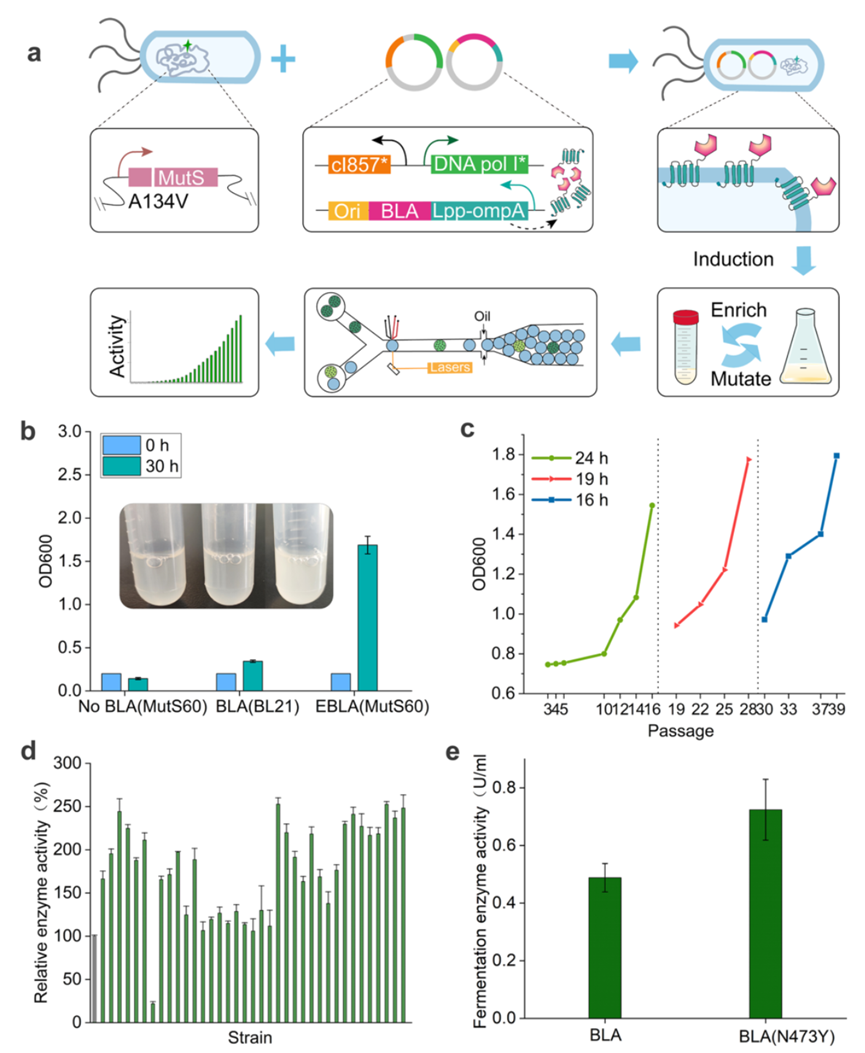
图4.微流控液滴筛选辅助α-淀粉酶的体内进化
接下来,研究人员将体内诱变系统与液滴微流控筛选相结合,增强α-淀粉酶(BLA)活性。为了构建体内BLA连续进化系统,将野生型BLA融合ORF插入到ColE1序列上游的靶质粒中。然后,将该质粒(BLA-ori)与突变质粒共转化到细胞中,生成BLA进化库。经过一轮诱变富集后的培养物OD600明显高于对照菌株,在30 h时达到1.5。并且随着连续传代次数的增加,其在富集培养基中的生长速度呈逐渐增加的趋势。这表明体内进化系统可以有效地丰富突变体,增加BLA酶的活性。
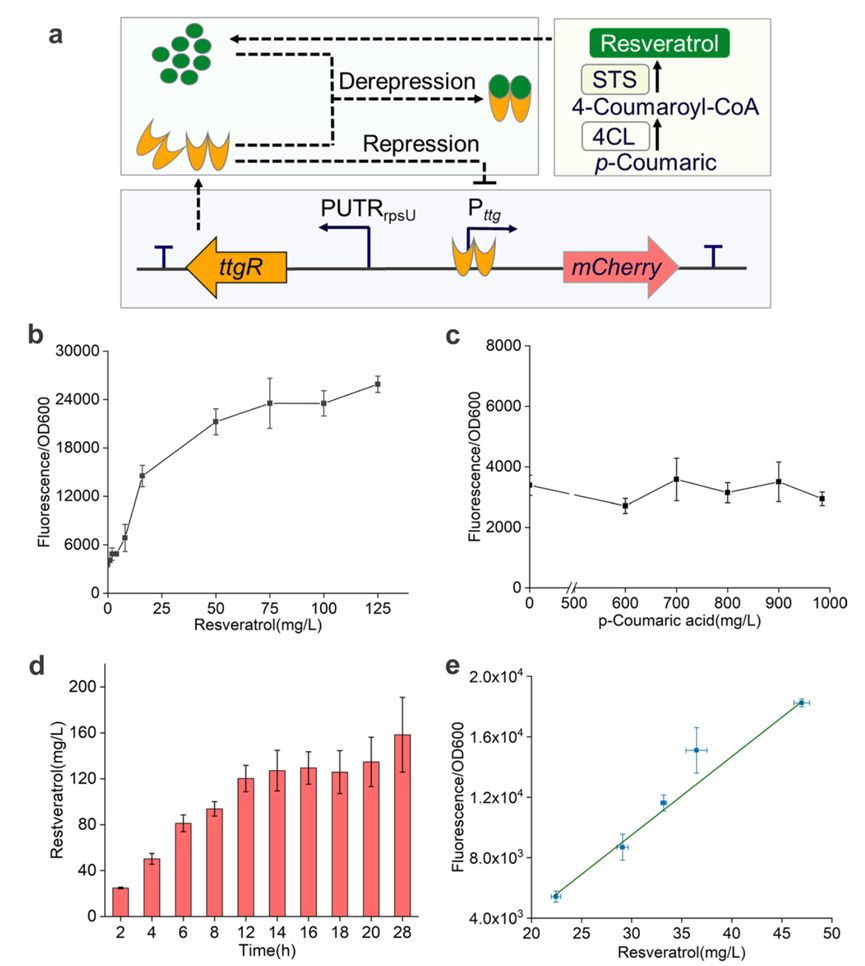
图5.工程大肠杆菌白藜芦醇生物合成途径的体内进化
为了实现白藜芦醇生物合成途径的体内进化,研究人员建立了一种基于生物传感器的FACS方法。为了验证响应强度和范围,加入不同浓度的对香豆酸和白藜芦醇进行荧光检测。对香豆酸的响应比白藜芦醇低得多,这表明该传感器对白藜芦醇具有良好的特异性。在900 mg/L对香豆酸存在下摇瓶发酵28 h后,白藜芦醇滴度大约为160mg/L。由于荧光强度与白藜芦醇滴度呈正相关,表明该生物传感器可用于白藜芦醇生物合成途径进化。
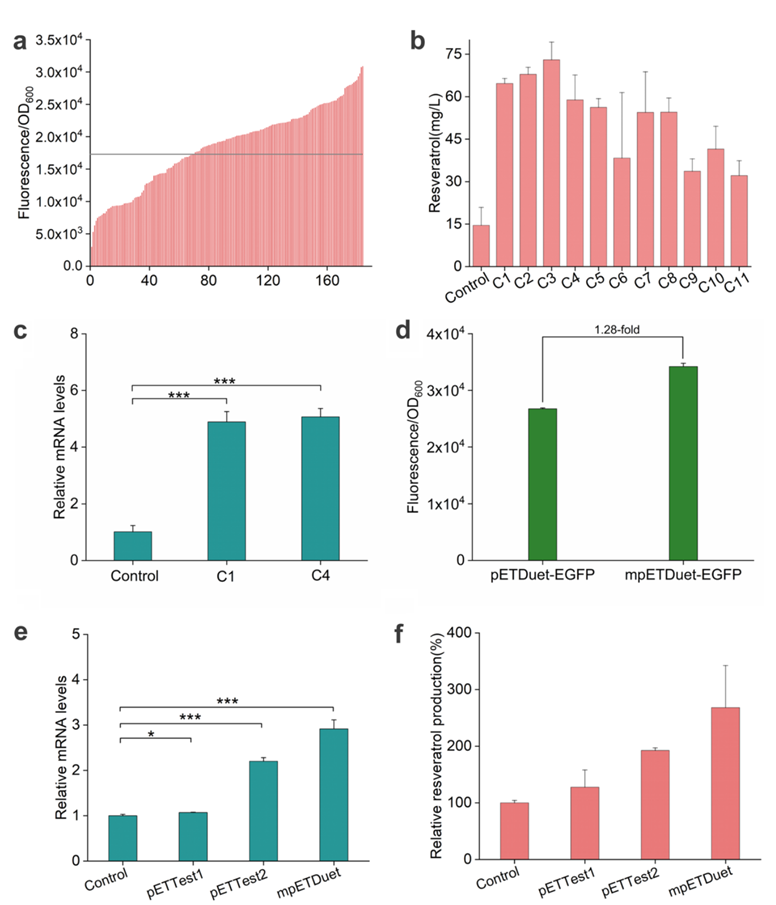
图6.白藜芦醇高产菌株的超高通量筛选
接下来,研究人员使用流式细胞术对饱和培养的高荧光强度细胞进行分选。在0.592‰的分选阈值下,共收集了5000个细胞,超过60%的细胞的荧光强度比起始菌株有所提高。从荧光强度最高的11株菌株中提取质粒,转入BL21 (DE3)中,所选菌株的白藜芦醇滴度是对照组的两倍以上。同时,在含有mpETDuet的重组染色中,STS的相对mRNA水平大约是野生型的4倍。这些结果表明Δ5526-6717的缺失极大地促进了mRNA转录和白藜芦醇的产生。总之,该研究通过引入温控易错的DNA Pol I和温度敏感的基因组MutS缺陷突变,证明了一个体内连续进化系统的温控诱导,将靶向突变率提高了600倍以上。通过与荧光超高通量筛选方法结合,能够高效筛选具有所需α-淀粉酶和白藜芦醇生物合成表型的突变体。最终获得α-淀粉酶活性提高48.3%,白藜芦醇产量提高1.7倍的突变体,表明热响应的超高通量体内定向进化是加速蛋白质工程和微生物细胞工厂建设的具有前景的方法。
