D-阿洛酮糖是一种重要的稀少糖,在食品、化妆品和医药等领域都有着广泛的应用价值。目前,工业上生产D-阿洛酮糖以生物酶法为主。由于传统酶法存在步骤烦琐、成本高、产物纯化分离难等缺点,已难以满足工业生产需要。近年来,全细胞合成体系以其低成本、便操作、易分离等特点受到人们的关注。江南大学生物工程学院/糖化学与生物技术教育部重点实验室的胡扬帆,王雨露,费康清,俞姝瑶,李子杰,江南大学食品学院的高雅慧以一种来源于Caballeronia insecticola的D-阿洛酮糖 3-差向异构酶(DAEase)为研究对象,实现了在生产安全菌株枯草芽孢杆菌WB800中的高效异源表达,并以D-果糖为底物全细胞催化合成D-阿洛酮糖。为了提高DAEase的表达量,通过设计构建含有不同组成型启动子的重组菌株对其表达进行了优化。并对全细胞反应体系的条件(温度、pH值、金属离子、细胞浓度)进行了优化,探究了不同底物浓度下D-果糖的转化效率。结果表明:启动子PylbP介导下的重组DAEase在枯草芽孢杆菌WB800内具有较高的表达水平,重组DAEase全细胞反应的较适温度为65 ℃,较适pH值为9.5,较适金属离子为5 mmol/L Mg2+。采用全细胞方法以500 g/L D-果糖为底物制备D-阿洛酮糖,4 h内反应基本达到平衡,转化率为30.06%。研究旨在为D-阿洛酮糖工业规模化生产提供实验基础和理论依据。
稀少糖是指在自然界中含量极低且具有重要生理功能的一类单糖及其衍生物[1]。D-阿洛酮糖是稀少糖的一种,具有蔗糖甜度的70%,但产生的能量仅有其0.3%[2],因此被视为一种新型甜味剂,并于2014年获得美国食品和药物管理局批准为一般认为安全(generally recognized as safe,GRAS)食品[3]。除此以外,D-阿洛酮糖还具有多种生理功能,能够有效用于肥胖症[4]、糖尿病[5]、高血脂[6]等疾病的预防和治疗,同时还具有抗炎[7]、抗氧化[8]、防治神经组织退化[9]和动脉粥样硬化[10]等潜在功能,因此在食品、化妆品、医药等领域都具有较大的应用价值。现阶段,合成D-阿洛酮糖的方法主要有化学法[11-12]和酶催化合成法[13-15]。化学法合成D-阿洛酮糖由于具有步骤烦琐、效率低、对环境不友好的劣势在工业实际生产上受到制约[16]。相比之下,经济环保且易于产物分离纯化的生物酶法备受青睐。酶法合成D-阿洛酮糖主要是依靠D-阿洛酮糖 3-差向异构酶(D-allulose 3-epimerase,DAEase)催化D-果糖在C3位发生异构化实现的,目前已报道的DAEase约有30种,平衡转化率基本处于24%~33%[17]。然而,传统酶法存在酶纯化步骤烦琐与产物分离困难等弊端,制约了其在工业化生产中的应用。近年来,利用全细胞制剂[18]合成目标产物由于具有成本低、操作简便、产物易分离、稳定性好等特点备受人们关注。枯草芽孢杆菌作为公认的GRAS菌株,是用作全细胞制剂宿主的极佳选择[19]。Patel等[20]从热水生境宏基因组中挖掘出具有催化D-果糖异构化D-阿洛酮糖活性的新型DAEase基因(DaeM),并利用枯草芽孢杆菌重组全细胞在20 h内催化500 g/L D-果糖转化合成150 g/L D-阿洛酮糖; Hu[21]在枯草芽孢杆菌中异源表达了Clostridium scindens ATCC 35704来源的DAEase,通过优化反应条件,重组全细胞在450 g/L底物存在下催化反应8 h可达到28.45%的最大平衡转化率。目前,D-阿洛酮糖的相关研究主要集中于DAEase新酶挖掘、分子改造以及固定化,对于全细胞工艺的研究相对不多。本研究以实验室前期挖掘的Caballeronia insecticola来源的dae基因[22]为研究对象,通过启动子优化策略[23]实现了在生产安全菌株枯草芽孢杆菌WB800中的高效异源表达,然后利用全细胞制剂制备D-阿洛酮糖并探究了全细胞催化的较优条件,实现了D-阿洛酮糖的高效制备,同时免去了复杂的酶纯化工艺与产物分离工序,进一步降低了工业生产成本。本研究旨在开发一种安全高效的全细胞制剂,建立简便、经济的生物催化方法,为工业化大规模生产D-阿洛酮糖提供实验基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株和质粒本研究中所使用的发酵菌株为枯草芽孢杆菌WB800,保藏于本实验室;大肠杆菌XL10-Gold用于质粒构建和扩增,保藏于本实验室;质粒pP43NMK用于D-阿洛酮糖 3-差向异构酶表达载体的构建,质粒pMA0911用于启动子PHpaII的扩增,均保藏于本实验室。本研究中所使用的引物见表1。
表1 重组质粒构建中使用的引物序列

1.1.2 酶和试剂BamHI、KpnI、PstI限制性内切酶、DNA聚合酶、dNTPs、蛋白Marker(Blue Plus II)、DNA Marker(1 kb plus),宝生物工程(大连)有限公司;质粒抽提及纯化试剂盒、抗生素,生工生物工程(上海)股份有限公司;One Step Cloning Kit一步法克隆试剂盒,天霖生物科技无锡有限公司;一抗Anti-His-mouse、二抗Anti-Mouse-HRP,全式金生物技术有限公司;D-果糖、D-阿洛酮糖标准品等其他试剂,上海阿拉丁生化科技股份有限公司;硫酸锌、硫酸镍、氯化钙、硫酸镁、氯化钴、硫酸锰、硫酸铜、硫酸亚铁,国药集团化学试剂有限公司。1.1.3 培养基LB固体培养基:酵母提取物1 g,胰蛋白胨2 g,氯化钠2 g,琼脂粉4 g,加蒸馏水至200 mL,121 ℃高压蒸汽灭菌20 min(不加琼脂粉的为LB液体培养基)。TB培养基:酵母提取物24 g,胰蛋白胨12 g,KH2PO4 2.31 g,K2HPO4 12.54 g,甘油4 mL,无机盐离子与营养成分于121 ℃下分开灭菌20 min,于超净台内混合配制,并用蒸馏水定容至1 000 mL。培养基中添加的抗生素质量浓度分别为氨苄青霉素100 μg/mL、卡那霉素50 μg/mL。
1.2 仪器与设备
T100TM型PCR仪,美国伯乐公司;HYL-A型恒温摇床,江苏太仓强乐实验仪器有限公司;PAC300型电泳仪/Bio-Rad Power,美国伯乐公司;ACQUITY Arc型高效液相色谱系统,美国Waters科技有限公司,配置Waters 2414示差检测器,Sugar-PakTM分析柱(300 mm×6.5 mm) ;TS100型恒温混匀仪,杭州瑞诚仪器有限公司。
1.3 实验方法
1.3.1 不同启动子重组质粒的构建来源于C. insecticola的dae基因(GenBank登录号:BAN26336.1)为本实验室此前挖掘[22],根据枯草芽孢杆菌的偏好性对其进行密码子优化,并交由天霖生物科技无锡有限公司合成。根据序列设计引物(表1),对基因进行PCR扩增,插入至pP43NMK载体的KpnI、PstI酶切位点之间,得到重组质粒pP43NMK-P43-dae。测序结果由苏州金唯智生物科技有限公司提供,以验证重组质粒是否成功构建。以枯草芽孢杆菌WB168基因组为模板,用表中所列引物F/R扩增出含有PylbP与PlytR启动子序列的片段及对应dae基因片段;以pMA0911质粒载体为模板,扩增出PHpaII启动子及对应dae基因片段,利用一步法克隆试剂盒,替换pP43NMK-P43-dae重组质粒上BamHI和PstI酶切位点间的P43-dae片段。1.3.2 重组菌的构建、培养和表达将成功构建的不同启动子介导的重组质粒按照Spizizen法[24]分别转化至枯草芽孢杆菌WB800中得到重组表达菌株WB800/pP43NMK-P43-dae、WB800/pP43NMK-PHpaII-dae、WB800/pP43NMK-PylbP-dae和WB800/pP43NMK-PlytR-dae,然后接种至5 mL LB培养基(含50 μg/mL卡那霉素),经37 ℃、220 r/min培养过夜后,以2%接种量转接至新鲜的50 mL TB培养基(含50 μg/mL卡那霉素)中,继续培养约15 h,5 000 r/min条件下收集菌体,用适量的50 mmol/L Tris-HCl(pH=7.5)缓冲液进行重悬,加入5×SDS,加热煮沸10 min,15 000 r/min离心10 min后获取样品进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),并利用考马斯亮蓝染色法和免疫印迹法(Western blotting)对蛋白质分子量大小进行分析。1.3.3 D-果糖和D-阿洛酮糖的定量检测采用HPLC对全细胞反应中的底物D-果糖和产物D-阿洛酮糖进行定量检测分析。色谱柱为Sugar-PakTM分析柱(300 mm×6.5 mm),流动相为500 mg/L EDTA钙盐,流速为0.5 mL/min,检测器为示差检测器,柱温为80 ℃,进样量为20 μL。1.3.4 全细胞制剂催化活性的验证经Western blotting验证后的菌液在5 000 r/min条件下离心10 min,收集菌体并洗涤3次,于4 ℃保存备用。将200 g/L的D-果糖和终质量浓度为50 g/L的重组全细胞制剂加入至50 mmol/L Tris-HCl(pH=7.5)缓冲体系中,于37 ℃、800 r/min条件下反应2 h。反应结束后,15 000 r/min条件下离心收集上清,经适当稀释后通过0.22 μm的滤膜进行除杂,用HPLC检测产物是否产生。1.3.5 全细胞摇瓶培养时间的优化重组菌株WB800/pP43NMK-PylbP-dae接种至5 mL含有50 μg/mL卡那霉素的LB培养基中,37 ℃下过夜培养,次日以2%接种量转接至新鲜的50 mL TB培养基中继续培养,于不同时间点取等量的湿细胞,测定并比较37 ℃下全细胞在2 h内催化200 g/L D-果糖转化为D-阿洛酮糖的转化率。1.3.6 全细胞催化合成D-阿洛酮糖的条件优化1.3.6.1 温度和pH值对全细胞催化合成D-阿洛酮糖的影响在不同设定温度(30~80 ℃)下探究温度对全细胞催化效率的影响,反应在含有200 g/L D-果糖及5 mmol/L Mg2+的50 mmol/L Tris-HCl(pH=7.5)缓冲液体系中进行,湿细胞添加量设定为50 g/L,反应时间为1 h。更换不同pH值的50 mmol/L缓冲液(PBS缓冲液pH值为6.0~7.0;Tris-HCl缓冲液pH值为7.0~9.0;Glycine-NaOH缓冲液pH值为9.0~11.0),对全细胞反应的较适pH值进行探究,反应在65 ℃条件下进行。采用相对活性对实验结果进行表征。相对活性定义:在较适条件下将测得的全细胞催化最高酶活力定义为100%,其他条件下所测得值与之比值即为相对活性。1.3.6.2 金属离子对全细胞催化合成D-阿洛酮糖的影响在酶促反应过程中,金属离子通常对于底物与酶的结合及稳定中间体构象的生成有着重要作用[25]。目前报道的DAEase均具有金属依赖性,因此金属离子的添加对于全细胞催化有着颇为重要的意义。通过添加不同金属离子(Zn2+、Ni2+、Ca2+、Mg2+、Co2+、Mn2+、Cu2+、Fe2+)并优化其较适浓度,探究其对全细胞催化反应的影响,反应在65 ℃、pH=9.5的条件下进行。采用相对活性对实验结果进行表征。1.3.6.3 细胞浓度对全细胞催化合成D-阿洛酮糖的影响以不同湿细胞质量浓度(10、20、30、40、50、60、80、100 g/L)进行全细胞催化反应,测定全细胞转化合成D-阿洛酮糖的量。反应体系为65 ℃,pH=9.5,5 mmol/L Mg2+。采用相对活性对实验结果进行表征。1.3.6.4 全细胞的热稳定性和pH值稳定性的测定取40 g/L的湿细胞,在不同温度(45、55、65、75 ℃)下预处理0~6 h,以未预处理样品作为对照,不同时刻下取样并在所得的较适条件下反应1 h,测定其残余活性以表征其热稳定性;在不同pH值条件下于4 ℃预处理2 h,以未作预处理样品作为对照,测定其残余活性以表征其pH值稳定性。1.3.6.5 优化条件下全细胞催化D-果糖合成D-阿洛酮糖转化率的测定采用pH=9.5的Gly-NaOH缓冲液分别配制100、300、500 g/L D-果糖溶液,分别检测较适条件下全细胞制剂催化不同浓度D-果糖合成D-阿洛酮糖的转化,计算反应转化率。
1.4 数据处理
实验结果均采用平均值±标准差表示;采用Origin 8.5软件进行数据处理及绘图。
2 结果与分析
2.1 不同启动子重组菌的构建和表达结果
按1.3.1节所述方法扩增出C. insecticola来源的dae基因片段,插入到pP43NMK载体的KpnI、PstI酶切位点之间,构建重组质粒pP43NMK-P43-dae。然后,分别扩增出两端含有同源臂的组成型启动子PHpaII、PylbP、PlytR片段和相应dae片段,利用一步法克隆试剂盒构建得到相应重组质粒pP43NMK-PHpaII-dae、pP43NMK-PylbP-dae和pP43NMK-PlytR-dae,同时以未异源表达dae基因的pP43NMK质粒载体作为对照,分别转化至枯草芽孢杆菌WB800中进行表达,见图1。通过SDS-PAGE[图1(a)]和Western blotting[图1(b)]检测不同启动子介导下DAEase在细胞内的表达水平。结果表明,检测到的蛋白质条带大小与理论值(33.6 kDa)基本一致,其中PylbP启动子介导下DAEase表达水平较高。
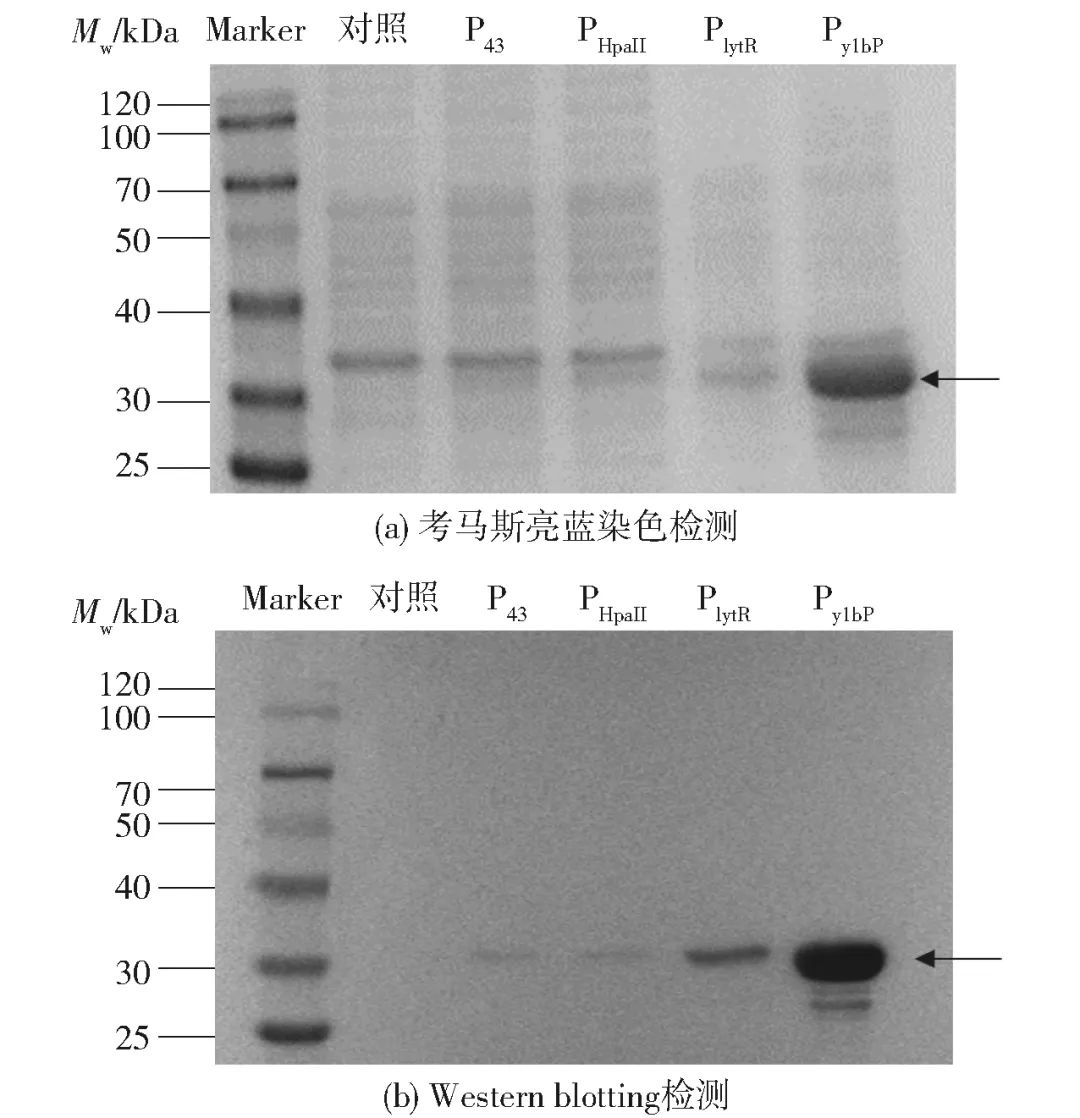
图1 不同启动子介导的重组DAEase的表达水平
2.2 全细胞制剂催化活性的验证结果
对重组枯草芽孢杆菌的全细胞催化性能进行验证,检测其是否具备转化D-果糖生产D-阿洛酮糖的能力,见图2。通过HPLC分别对D-果糖、D-阿洛酮糖标准品以及全细胞反应的上清液进行分析,HPLC结果见图2(a)~(c)。这表明枯草芽孢杆菌内异源表达的DAEase表现出了对D-果糖的催化活性,能够生成D-阿洛酮糖产物。
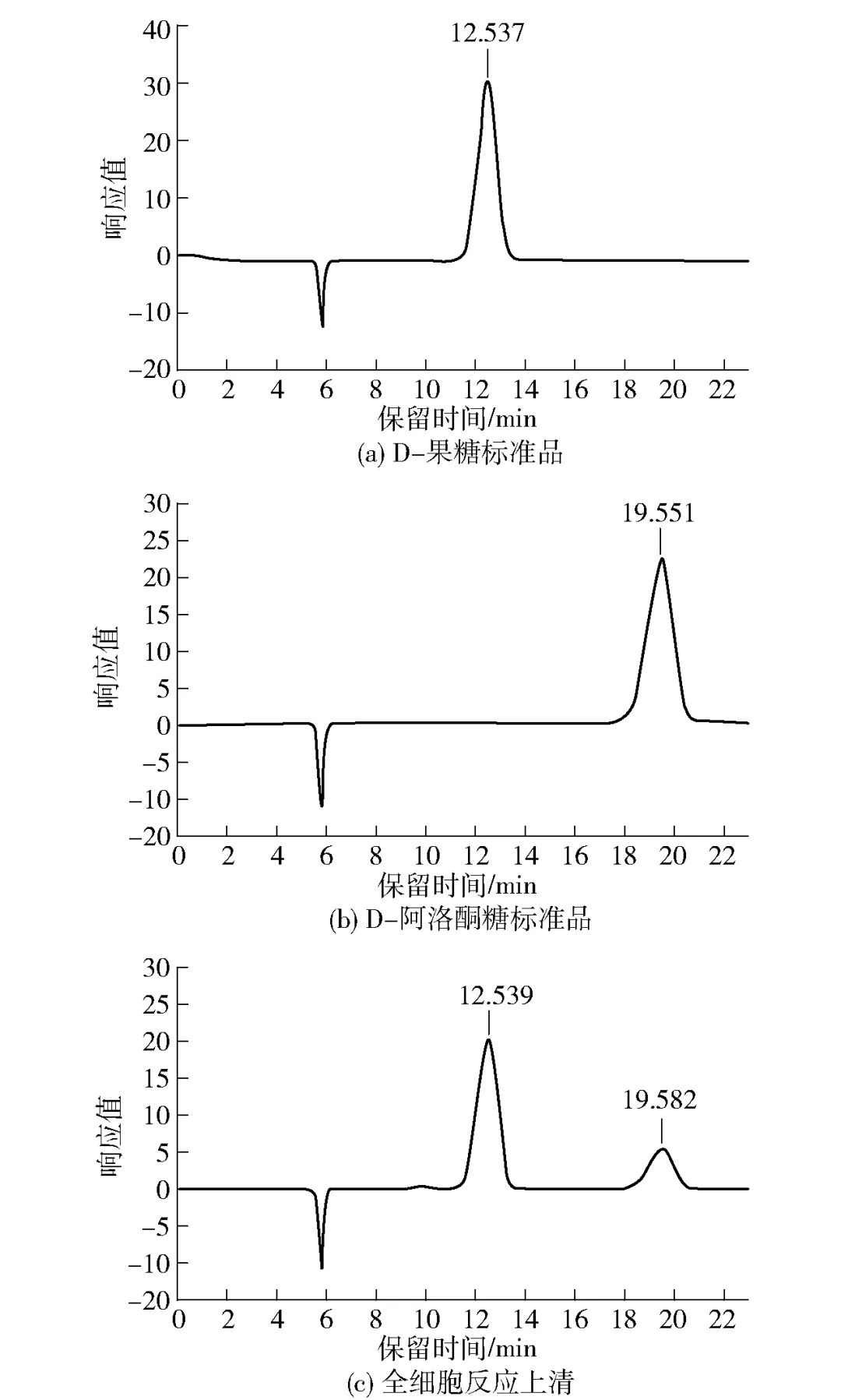
图2 HPLC验证全细胞催化活性
2.3 全细胞摇瓶培养时间的优化结果
将种子液以2%的接种量转接至新鲜TB培养基进行培养,于不同时间点收获等量的菌体,用于全细胞转化实验,比较不同时刻所收集的全细胞2 h内催化D-果糖合成D-阿洛酮糖的转化率,见图3。结果表明,摇瓶培养15 h左右时所收获的全细胞用于催化合成D-阿洛酮糖可以获得较高的转化率。因此,选择摇瓶培养15 h所收获的全细胞用于后续全细胞反应条件优化实验。
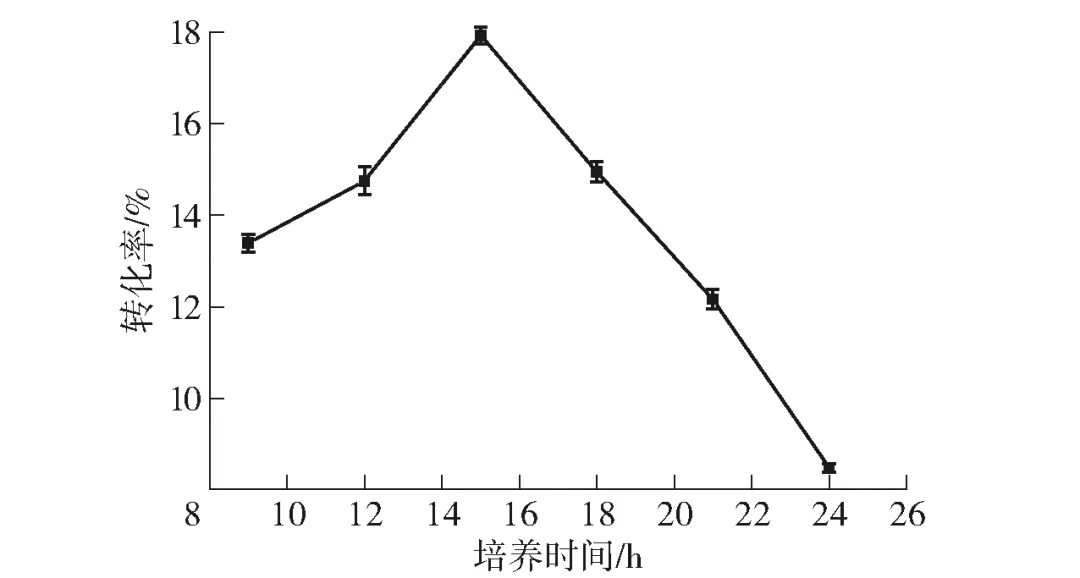
图3 全细胞摇瓶培养时间对D-果糖转化率的影响
2.4 枯草芽孢杆菌WB800/pP43NMK-PylbP-dae重组全细胞反应条件的优化
2.4.1 温度对全细胞催化酶活力及稳定性的影响温度是影响全细胞催化效率最重要的因素之一,较高的反应温度可以使得生产过程中在维持高催化效率的同时降低染菌的可能。目前,已报道的DAEase在催化反应中的较适温度的范围为40~70 ℃。因此,探究了温度对全细胞合成D-阿洛酮糖的影响,见图4。结果表明,全细胞反应的较适温度为65 ℃,当温度超过65 ℃后,酶活力迅速下降,75 ℃条件下全细胞酶活力仅为较适温度下酶活力的10%[图4(a)]。此外,研究了温度对全细胞稳定性的影响,由图4(b)结果可见,65 ℃以下温度预处理1 h几乎不会对全细胞酶活力造成损失,并且6 h后依旧能保持50%以上的相对酶活;温度提高至75 ℃时,全细胞酶活性迅速下降,预处理仅半小时的全细胞活性完全丧失。
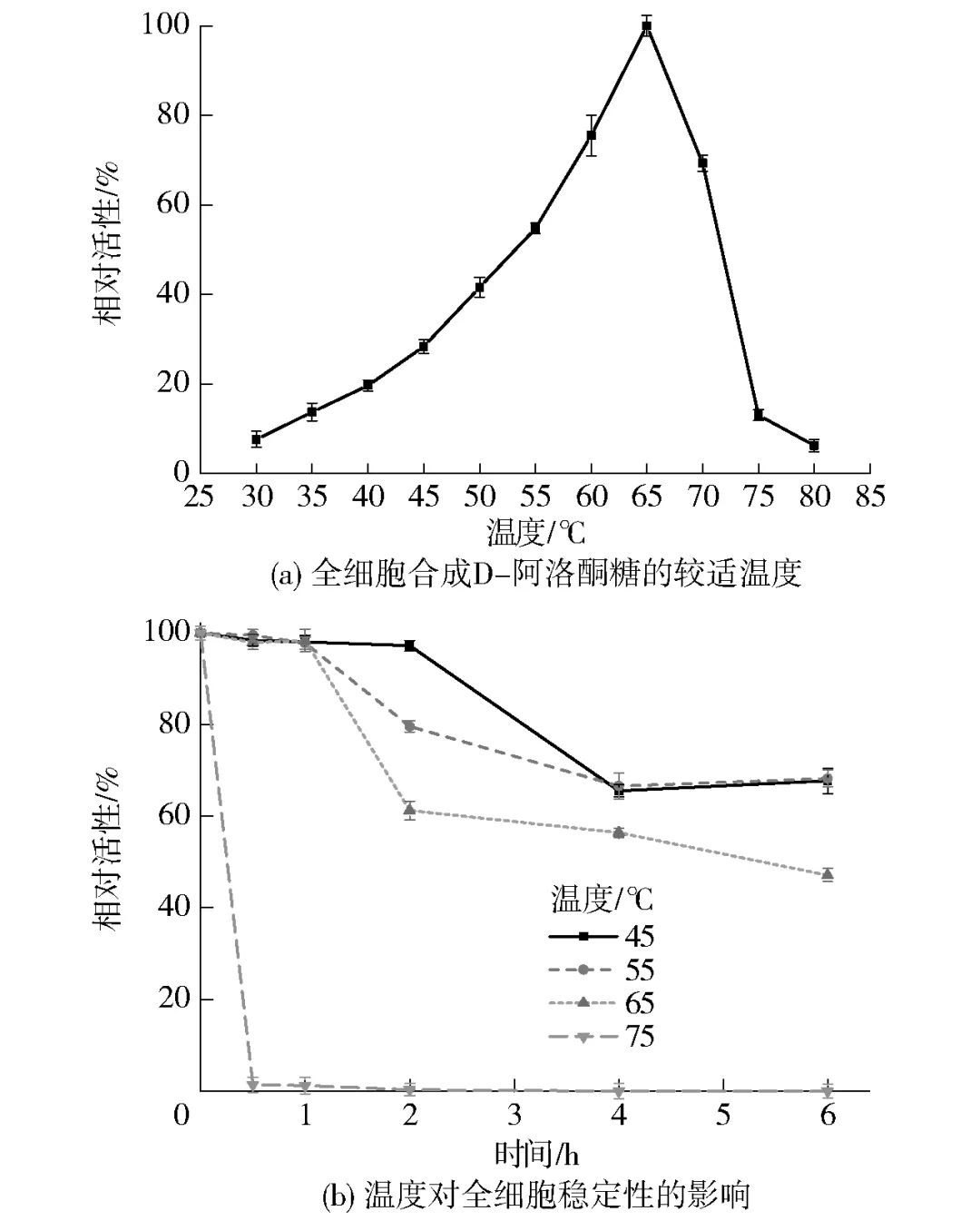
图4 温度对全细胞合成D-阿洛酮糖的影响
2.4.2 pH值对全细胞催化酶活力及稳定性的影响在D-果糖异构化D-阿洛酮糖的反应中,较适pH值一般为7.0~9.0,少数DAEase呈现出偏弱酸性的较适pH值。因此,探究了不同pH值对全细胞合成D-阿洛酮糖的影响,见图5。结果表明,全细胞催化反应的较适pH值为9.5[图5(a)],且当pH值处于9.0~11.0的碱性条件下时,全细胞普遍呈现出较高水平的酶活力,这表明该来源的DAEase对较高的pH值具有偏好性。此外,探究了pH值在6.0~10.0的DAEase全细胞的稳定性,结果表明pH值在6.0~10.0条件下预处理2 h对DAEase的酶活力基本没有影响,残余酶活力始终能够保持在90%以上,结果见图5(b)。
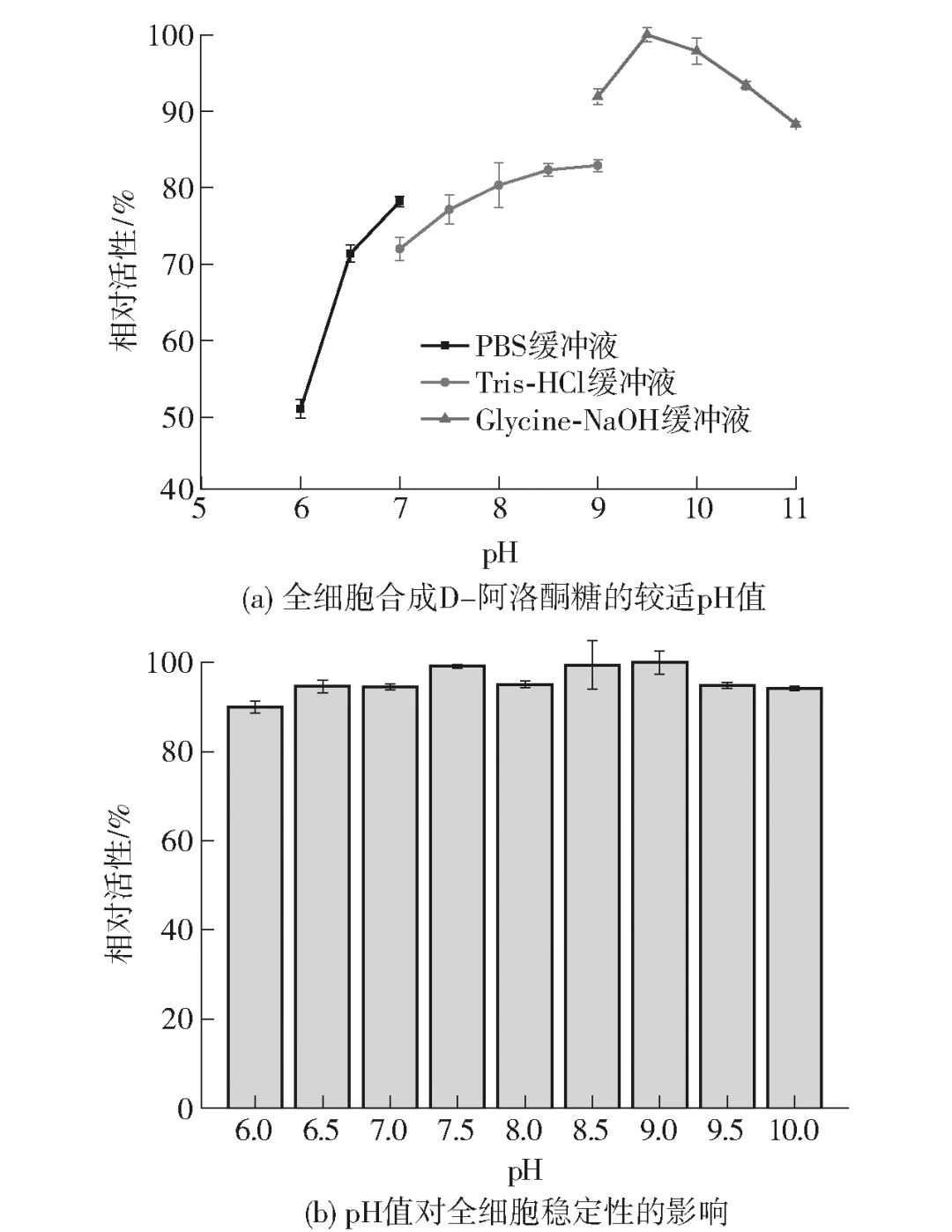
图5 pH值对全细胞合成D-阿洛酮糖的影响
2.4.3 金属离子对全细胞催化合成D-阿洛酮糖的影响目前已报道的大多数D-塔格糖 3-差向异构酶(D-tagatose 3-epimerase,DTE)家族酶均具有较强的金属依赖性,相似地,金属离子对于C. insecticola来源的DAEase在催化过程中也有着重要作用,图6中与对照相比,Mg2+、Co2+和Mn2+对DAEase的活性具有一定的促进作用,其中Mn2+提升效果较强,而Zn2+、Cu2+的存在极大地抑制了酶活性,见图6(a)。由于Co2+和Mn2+均属于重金属盐,考虑到合成的D-阿洛酮糖普遍用于食品、医药等领域,选择Mg2+作为较适金属离子。进一步地,改变Mg2+的浓度(0~20 mmol/L),以探究较适Mg2+添加量,见图6(b),最终确定5 mmol/L Mg2+用于全细胞催化为宜。
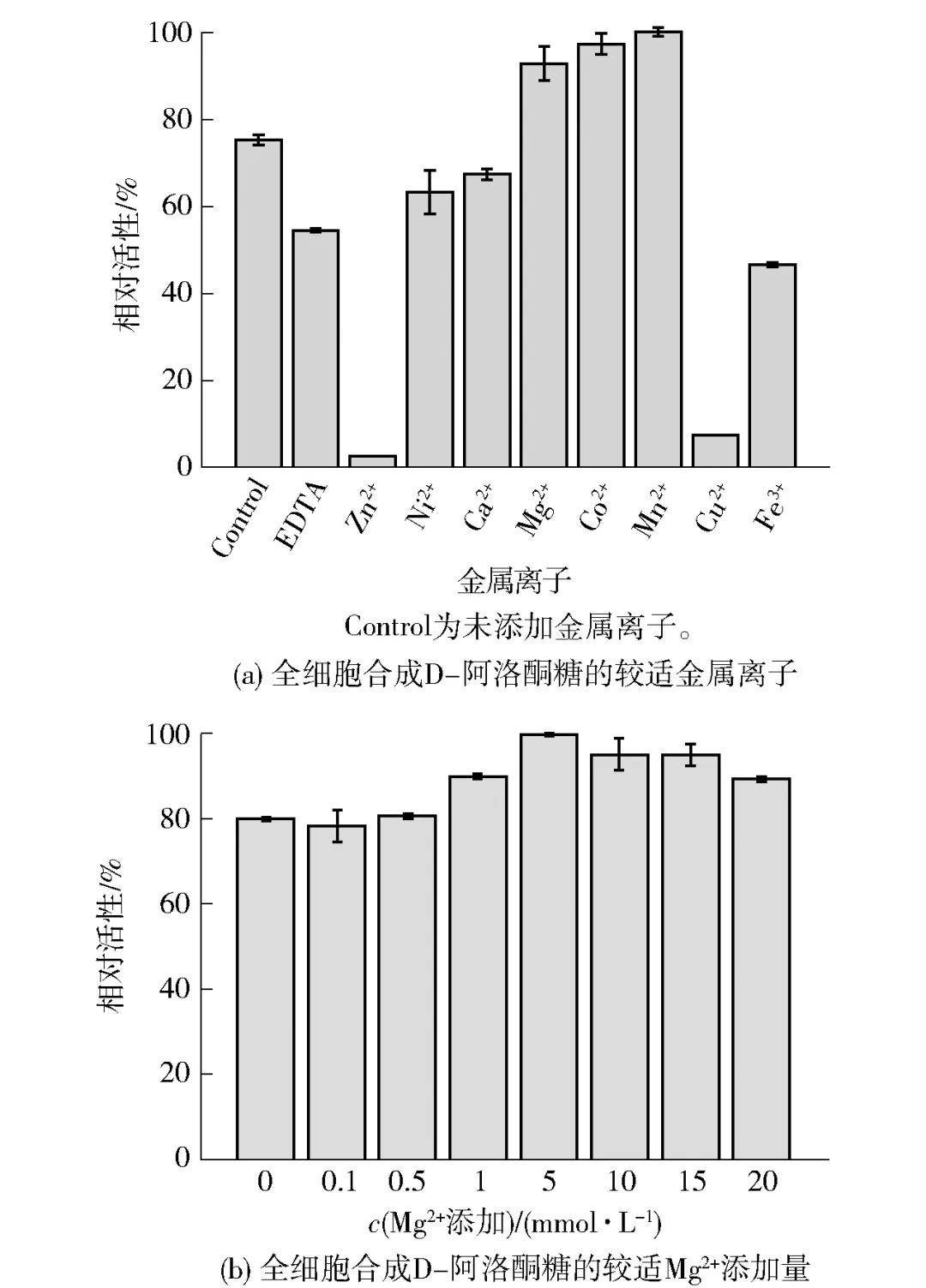
图6 金属离子对全细胞合成D-阿洛酮糖的影响
2.4.4 细胞浓度对全细胞催化合成D-阿洛酮糖的影响全细胞催化的本质是胞内酶的催化,不同的细胞浓度代表了不同的酶添加量。为满足实际工业生产应用中生产效率的需要,同时相应地降低生产成本,对全细胞反应体系中的细胞浓度进行优化。在较适反应条件下,利用不同浓度的湿细胞(10~100 g/L)生产D-阿洛酮糖,测定其相对酶活力,结果见图7。着细胞浓度的提升,全细胞体系酶活力也不断增加,细胞浓度达到40 g/L后,酶活力基本没有明显的提升。因此,结合考虑全细胞催化活性以及成本因素,选择40 g/L细胞用量作为全细胞较适添加量。
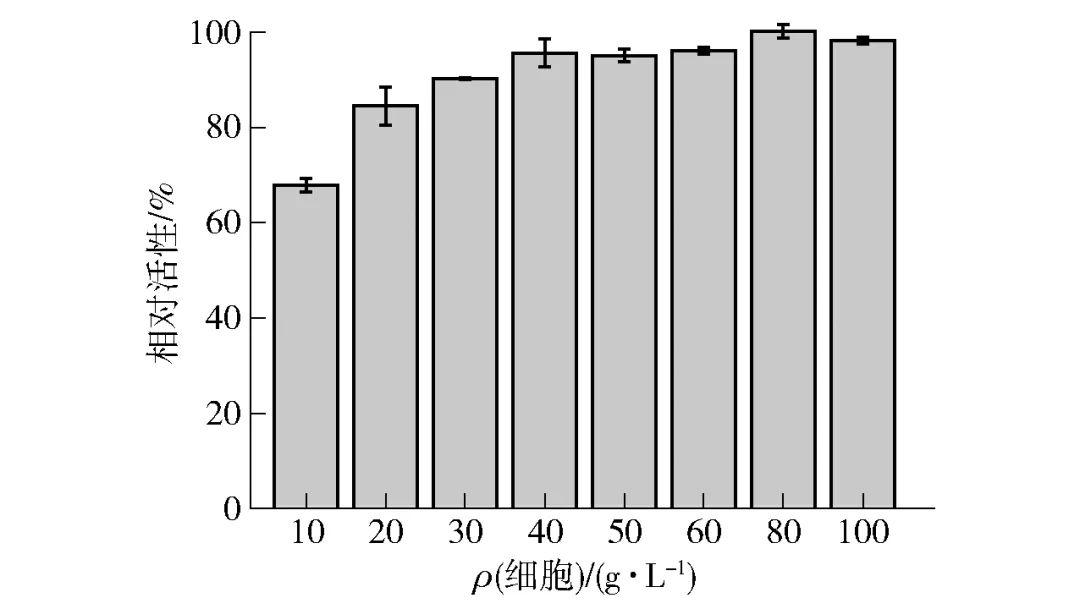
图7 细胞浓度对全细胞合成D-阿洛酮糖的影响
2.4.5 全细胞催化不同浓度D-果糖合成D-阿洛酮糖的转化率分别以100、300、500 g/L的D-果糖溶液作为底物,在40 g/L细胞量、5 mmol/L Mg2+存在的条件下于65 ℃进行催化反应,不同时间点进行取样,测定其转化率,实验结果见图8。由图8可知,果糖底物浓度为100 g/L时,1 h反应达到平衡,转化率为31.43%;果糖底物质量浓度为300 g/L时,2 h反应达到平衡,转化率为30.83%;果糖底物质量浓度提高至500 g/L时,4 h反应基本达到平衡,转化率为30.06%,并于 5 h 后不再变化,平衡转化率为30.57%。相比较目前已报道的全细胞催化D-阿洛酮糖的转化水平[20-21],重组C. insecticola来源DAEase表现出了良好的转化水平,同时较短的反应平衡时间表明该重组菌具有在实际工业生产中应用的潜力。
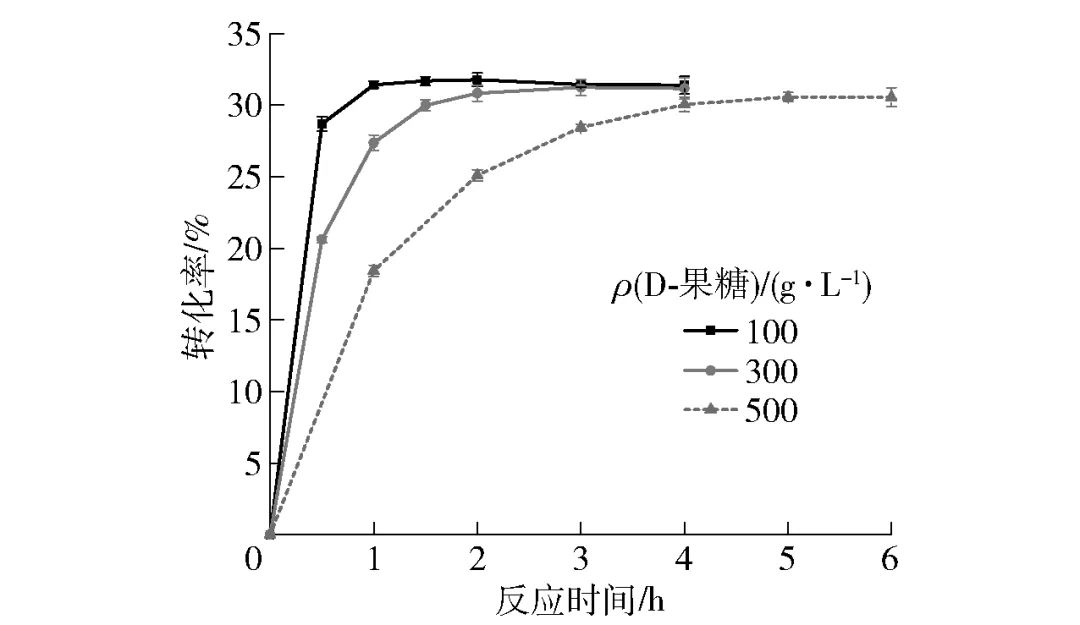
图8 全细胞催化不同浓度D-果糖合成D-阿洛酮糖
3 结 论
本研究以枯草芽孢杆菌WB800作为表达宿主,实现了C. insecticola来源DAEase的异源高效表达。通过启动子优化策略,筛选出能够实现DAEase高效表达的强启动子PylbP。以重组菌株WB800-PylbP-dae为研究对象,首先通过HPLC确定摇瓶培养15 h时收集的全细胞具有较高的催化活性。进而通过优化确定了全细胞体系反应的较适条件如下:温度65 ℃、50 mmol/L Gly-NaOH(pH=9.5)缓冲液、5 mmol/L Mg2+、40 g/L湿细胞浓度。最后,以500 g/L D-果糖为底物,较适条件下全细胞转化4 h基本达到平衡,转化率为30.06%,表明该重组菌株具有成为生产D-阿洛酮糖理想菌株的潜力。本研究使用全细胞法合成D-阿洛酮糖,相较于传统酶法,省去了费时烦琐的蛋白纯化步骤,简化了生产工艺,降低了生产成本,可为实现D-阿洛酮糖食品级生产提供理论基础。此外,为最大限度地发挥酶的催化活性,缩短生产时间,同时降低生产过程中染菌的风险,D-阿洛酮糖的工业化规模生产中往往伴随着高温反应。因此进一步的研究可以考虑对该来源的DAEase酶进行分子改造,以更好地发挥其工业应用价值。
参考文献:略
引用格式:胡扬帆,王雨露,费康清,等.枯草芽孢杆菌全细胞转化高效合成D-阿洛酮糖[J].食品科学技术学报,2023,41(5):76-84.
HU Yangfan,WANG Yulu,FEI Kangqing,et al.Efficient synthesis of D-allulose by Bacillus subtilis whole cell transformation[J].Journal of Food Science and Technology,2023,41(5):76-84.
基金项目:国家自然科学基金资助项目(32171475);江苏省研究生科研与实践创新计划项目(KYCX22_2431);江苏省大学生创新训练重点项目(202210295054Z)。
Foundation:National Natural Science Foundation of China (32171475); Postgraduate Research &Practice Innovation Program of Jiangsu Province (KYCX22_2431); Undergraduate Training Program for Innovation and Entrepreneurship of Jiangsu Province (202210295054Z).
