幽门螺旋杆菌(Helicobacter pylori)是一种能引发慢性胃炎、消化性溃疡甚至胃癌的革兰氏阴性菌[1]。2021年,美国卫生与公众服务部(HHS)在《第15次致癌物报告中》将幽门螺旋杆菌列为明确人类致癌物[2]。全球约50%以上的人口感染了幽门螺旋杆菌,中国感染人数超过6亿[3]。幽门螺旋杆菌可经过口-口、胃-口、粪-口等途径进行传播,定植机体后难以自发清除,从而造成持久或终生感染。目前,治疗幽门螺旋杆菌感染的手段主要是将抗生素和质子泵抑制剂结合使用的三联或四联疗法。但随着幽门螺旋杆菌耐药性和复感染性的增高,使得通过抗生素去除幽门螺旋杆菌感染的效果逐渐下降,有些欠发达地区治疗失败率高达20%,WHO于2017年将幽门螺旋杆菌列为12种超级耐药菌之一[4]。20世纪90年代以来,幽门螺旋杆菌疫苗的开发一直是研究的热点,幽门螺旋杆菌脲酶、空泡细胞毒素 A、细胞毒素相关抗原和中性粒细胞活化蛋白都表现出一定的免疫活性。曾明、邹全明教授等人开发了尿素酶B与肠毒素B亚单位重组疫苗,在III期临床中的保护率高达71%[5]。然而,目前市场上仍然还未有成熟疫苗用于治疗和预防幽门螺旋杆菌感染。
致病菌表面的脂多糖或荚膜多糖是其重要的抗原表位,能在动物体内引起特异性的免疫反应[6]。Monteiro等人证明,从不同血清型幽门螺旋杆菌提取的脂多糖与载体蛋白结合后,都能成功诱导小鼠模产生特异性IgG抗体,并且产生的抗体都可以识别脂多糖中保守的核心寡糖部分[7]。因此,作者将幽门螺旋杆菌脂多糖核心十一糖作为目标分子开展化学合成研究,可用于针对多种血清型的广谱性糖结合疫苗的开发。

图1. 幽门螺旋杆菌脂多糖核心十一糖结构及合成难点
核心十一糖由一个八糖骨架a-D-Glc-(1→3)-a-D-Glc-(1→4)-b-D-Gal- (1→7)-[a-D,D-Hep-(1→2)]-a-D,D-Hep-(1→2)-a-L,D-Hep-(1→3)-a-L,D-Hep[P/AEP]-(1→5)-Kdo以及一个a-(1→6)-葡聚三糖支链构成[8](图1),它的合成极具挑战性:1)结构中含有D,D-Hep,L,D-Hep,Kdo三种高碳糖,高碳糖砌块的制备需以五碳糖、六碳糖为起始原料进行碳链延长;2)此十一糖是由多个高碳糖组成并含有支链的结构,糖环上羟基密度相对较大,合成过程中不同阶段都可能存在较大的立体空间位阻;3)结构中含有多个低活性羟基连接位点(Gal-4OH,Hep-2OH,Kdo-5OH),糖基供体-受体的不匹配性容易造成糖基化反应产率下降;4)结构中存在5个具有合成挑战性的a-葡萄糖苷键;5)结构中包含多种不同的糖苷键连接方式(1→2, 1→3, 1→4, 1→5, 1→6, 1→7连接),在合成过程中需对正交保护策略进行周详的设计。

图2. 幽门螺旋杆菌脂多糖核心十一糖的组装序列优化
在本研究中,通过逆合成分析,结合该课题组庚聚糖前期合成经验,预先排除了[8+3](strategy I)的模块化合成策略,而采用[3+(3+(2+3))](strategy II)的组装策略(图2)。作者利用正交保护的单糖合成所需的四种糖基模块后按照从还原端至非还原端的顺序对模块进行组装。无论是二糖采用硫糖苷供体还是三氟乙酰亚胺酯基供体,都无法通过[2+3]组装策略(strategy II)合成五糖(图3),我们推测这是由于三糖受体的空间位阻太大而造成的。
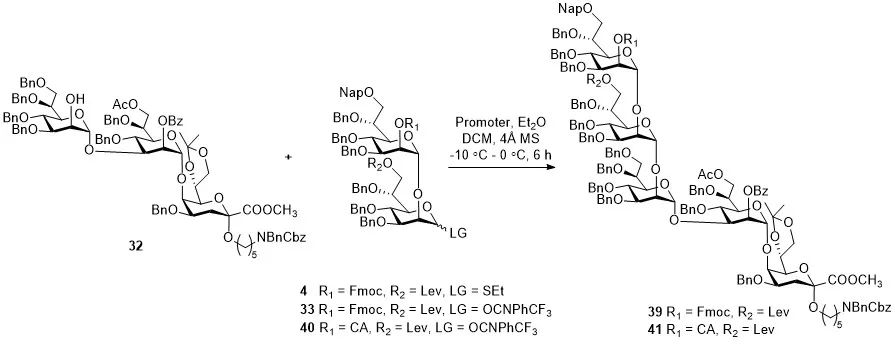

图3. 尝试[2+3]策略合成五糖
作者通过减小供体的大小,采用[1+1+3](strategy III)组装策略,可以高效的完成还原端五糖的制备(图4)。进一步将三糖模块与还原端五糖受体进行偶联成功制备得到八糖,将八糖受体与另一三糖供体模块进行糖基化反应,作者尝试了多种反应条件,均未能得到目标十一糖(图4)。经分析认为[3+8](strategy III)糖基化失败的主要原因是由于八糖受体的结构较大,D,D-庚糖残基上的7位伯羟基处于一个相对拥挤的空间环境,不利于与三糖供体的结合。因此,最后通过减小供体,先将半乳糖单糖供体与八糖受体反应,高产率合成得到九糖。九糖制成受体后再与硫糖苷二糖供体进行糖基化反应(strategy IV),成功合成得到目标十一糖,但产率只有21%,将硫糖苷供体换成活性更高的三氟乙酰亚胺酯基供体与九糖受体反应,十一糖的合成产率提高到了56%(图5)。此研究中作者经过多次组装序列优化,最后采用线性[2 + (1 + (3 + (1 + (1 + 3))))]合成策略完成了幽门螺旋杆菌脂多糖核心十一糖的合成,发现立体空间位阻是影响复杂寡糖合成的重要因素之一。
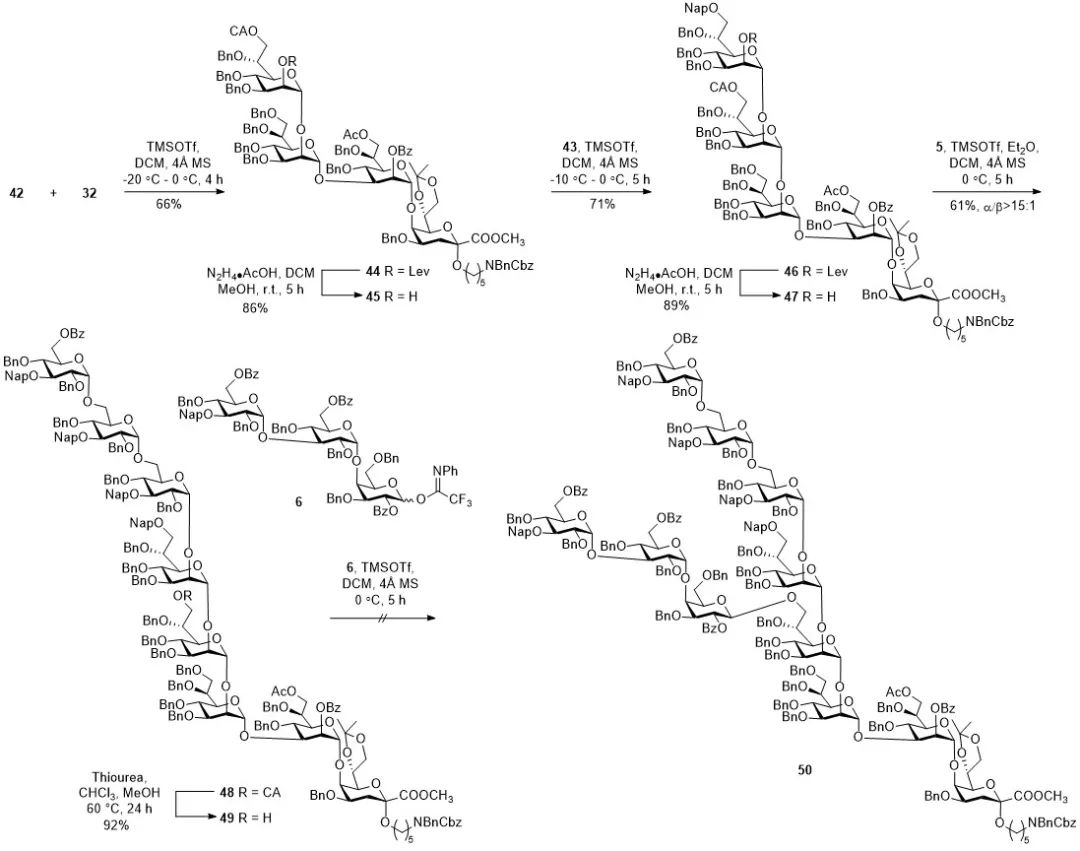
图4. 尝试十一糖的合成

图5. 十一糖的合成及脱保
此外,作者合成了内核心三糖57(图6),磷酸化内核心三糖58,a-葡聚三糖59,外核心五糖60,外核心八糖61,利用糖芯片技术开展了糖链抗原性分析(图7)。研究发现a-1,6-葡萄三糖与多数幽门螺旋杆菌感染者血清具有较强结合作用,是核心十一糖的重要抗原表位;磷酸化内核心三糖与感染者血清结合的数量及强度均明显高于无磷酸的内核心三糖,表明磷酸基团是核心十一糖的重要特异结构,此研究为幽门螺旋杆菌糖结合疫苗的开发提供了重要的理论基础。

图6 幽门螺旋杆菌脂多糖核心寡糖库的构建
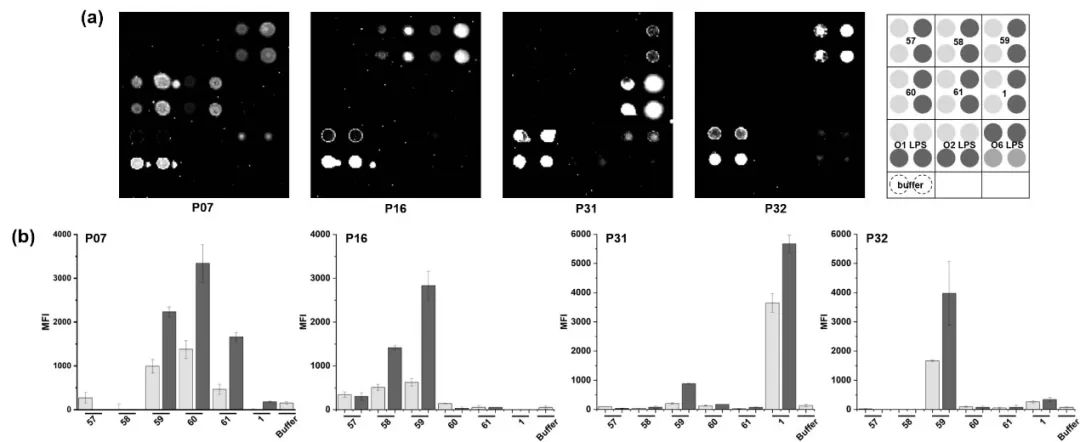
图7 幽门螺旋杆菌糖链抗原性分析
该研究成果发表于国际权威期刊《Journal of the American Chemical Society》(J. Am. Chem. Soc. 2022, 144, 14535−14547),并得到JACS主编Erick M. Carreira教授的高度认可和评价,称赞此工作为“Truly a landmark synthesis!”。糖化学与生物技术教育部重点实验室尹健教授为论文的通讯作者,邹小鹏博士,胡静副教授为该论文的共同第一作者。上述研究得到了国家自然科学基金(22077052, 21877052, 22177041, 21907039, 22107037),江苏省自然科学基金(BK20190575)的资助。
[ 原文链接 ]
https://doi.org/10.1021/jacs.2c03068
[ 参考文献 ]1. Atherton, J. C., The pathogenesis of Helicobacter pylori-induced gastro-duodenal diseases. J. Annu. Rev. Pathol. 2006,1 (1), 63-96.2.Program, N. T., NTP 15th Report on Carcinogens. Rep. Carcinog. 2021, 15, 1-10.3. Viana, I. D. S.; Santos, M. L. C.; Marques, H. S.; Gonalves, V. L. S.; Brito, B. B.; Silva, F. A. F.; Silva, N. O.; Pinheiro, F. D.; Teixeira, A. F.; Costa, D. T.; Souza, B. O.; Souza, C. L.; Oliveira, M. V.; Melo, F. F., Vaccine development against Helicobacter pylori: from ideal antigens to the current landscape. Expert Rev. Vaccines 2021, 20 (8), 989-999.4. Suzuki, S.; Esaki, M.; Kusano, C.; Ikehara, H.; Gotoda, T., Development of Helicobacter pylori treatment: How do we manage antimicrobial resistance? World J. Gastroenterol. 2019, 25 (16), 5-10.5. Zeng, M.; Mao, X. H.; Li, J. X.; Tong, W. D.; Wang, B.; Zhang, Y. J.; Guo, G.; Zhao, Z. J.; Li, L.; Wu, D. L.; Lu, D. S.; Tan, Z. M.; Liang, H. Y.; Wu, C.; Li, D. H.; Luo, P.; Zeng, H.; Zhang, W. J.; Zhang, J. Y.; Guo, B. T.; Zhu, F. C.; Zou, Q. M., Efficacy, safety, and immunogenicity of an oral recombinant Helicobacter pylori vaccine in children in China: a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 2015, 386 (10002), 1457-1464.6.Astronomo, R. D.; Burton, D. R., Carbohydrate vaccines: developing sweet solutions to sticky situations? Nat. Rev. Drug Discov. 2010, 9 (4), 308-24.7. Monteiro, M. A.; Britton, S.; Applebee, L. A.; Baqar, S., Synthesis and immunogenicity of a Helicobacter pylorilipopolysaccharide-based conjugate. Vaccine 2011, 29 (17), 3098-3102.8. Ferreira, J. A.; Silva, L.; Monteiro, M. A.; Coimbra, M. A., Helicobacter pylori cell-surface glycans structural features: role in gastric colonization, pathogenesis, and carbohydrate-based vaccines. Carbohydr. Chem. 2011, 37, 160-193.
