
导读
N-乙酰神经氨酸(NeuAc)被广泛用作营养食品和药物中间体,可在代谢工程大肠杆菌和枯草芽孢杆菌中合成。在提高免疫力的同时,NeuAc能帮助改善大脑发育和认知。然而,NeuAc的生物合成通常伴随着中间体的积累,这对产品产量与后续产品的纯化造成了深远的影响。在枯草芽孢杆菌的NeuAc生物合成途径中,糖化学与教育部重点实验室刘延峰团队通过聚焦于减少两种中间产物的积累,分别是N-乙酰葡萄糖胺(GlcNAc)与N-乙酰甘露糖胺(ManNAc),优化了NeuAc生物合成途径,构建了高效代谢工程菌株,从而改进NeuAc的生物生产。研究表明,通过构建NeuC途径与优化关键酶的表达水平,加强编码NeuAc合成酶(NeuB)的表达与辅助前体磷酸烯醇丙酮酸(PEP)的供应, NeuAc的产量得到了显著的提升。
文章简介
代谢工程通过重新分配细胞资源来构建微生物细胞工厂,进行化学生物制造。然而,代谢过剩和中间体积累通常伴随产品的生物合成,导致产品产量显著降低,同时阻碍下游产品的纯化。NeuAc可在枯草芽孢杆菌中通过三种途径合成,分别为AGE(N-乙酰-D-葡糖胺-2-差向异构酶)途径、NeuC(UDP-N-乙酰葡糖胺-2-差向异构酶)途径和NanE(N-乙酰葡糖胺-6-磷酸-2-差向异构酶)途径。然而,NeuAc的生物合成也面临着阻碍,中间体GlcNAc 与ManNAc的积累影响其生物生产。
近日,刘延峰团队基于减少中间产物积累的考虑,在枯草芽孢杆菌中构建了没有中间体GlcNAc形成的NeuC途径。通过不同强度的启动子优化了关键酶的表达水平。其次,通过定向进化NeuB与增强NeuAc辅助前体PEP的供应,显著减少中间体ManNAc的积累,NeuAc的效价增加了54.9%,达到7.9 g/L。最后,通过3L发酵罐的补料分批发酵,NeuAc的最大效价达到了21.8 g/L。
该工作在Food Bioengineering上以题为“Improved N-acetylneuraminic acid bioproduction by optimizing pathway for reducing intermediate accumulation”发表(DOI: 10.1002/fbe2.12030)。
我们摘取了文章里的几部分重点内容与大家分享:
1、构建NeuC途径以消除GlcNAc的产生
首先,在枯草芽孢杆菌中构建了没有中间体GlcNAc形成的NeuC途径。在NeuC途径中存在三种关键酶,分别是编码谷氨酰胺-果糖-6-磷酸转氨酶(GlmS)、编码磷酸葡糖胺变位酶(GlmM)和编码葡糖胺-1-磷酸乙酰转移酶(GlmU)。(图1)
接着,在第一轮启动子优化中,具有12.5倍强度差异的9个启动子PxpaC(P1)、PyceC(P2)、PlytR(P3)、PsdhB(P4)、PodhA(P6)、P333(P7)、PyvyD(P8)、Pveg(P9)和P566(P10)被选择以调节GlmS、GlmM和GlmU的表达水平。(图2a)发酵结果表明,来自大肠杆菌的GlmS总体上略微高效,在P2启动子的控制下,NeuAc效价达到3.89 g/L,ManNAc的积累达到4.27 g/L。对于GlmM来说,在P9启动子的控制下,枯草芽孢杆菌的NeuAc合成具有更好的性能,达到3.58 g/L。在第一轮优化中,当glmU由P3启动子控制时,NeuAc效价达到4.01 g/L, GlcNAc则被完全消除。(图2b)
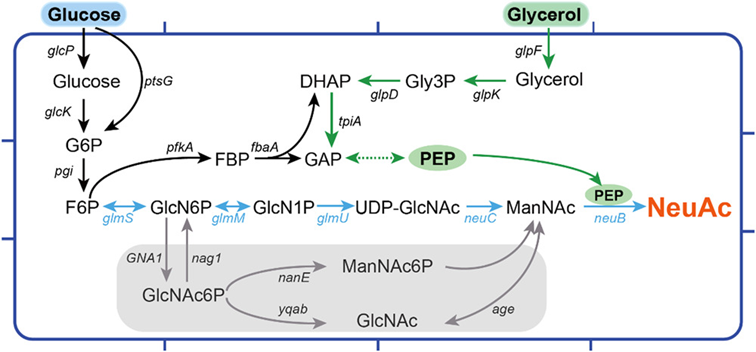
图1 枯草芽孢杆菌的NeuAc生物合成途径。绿色箭头表示甘油途径。蓝色箭头表示NeuC途径。AGE途径和NanE途径包含在灰色框中。
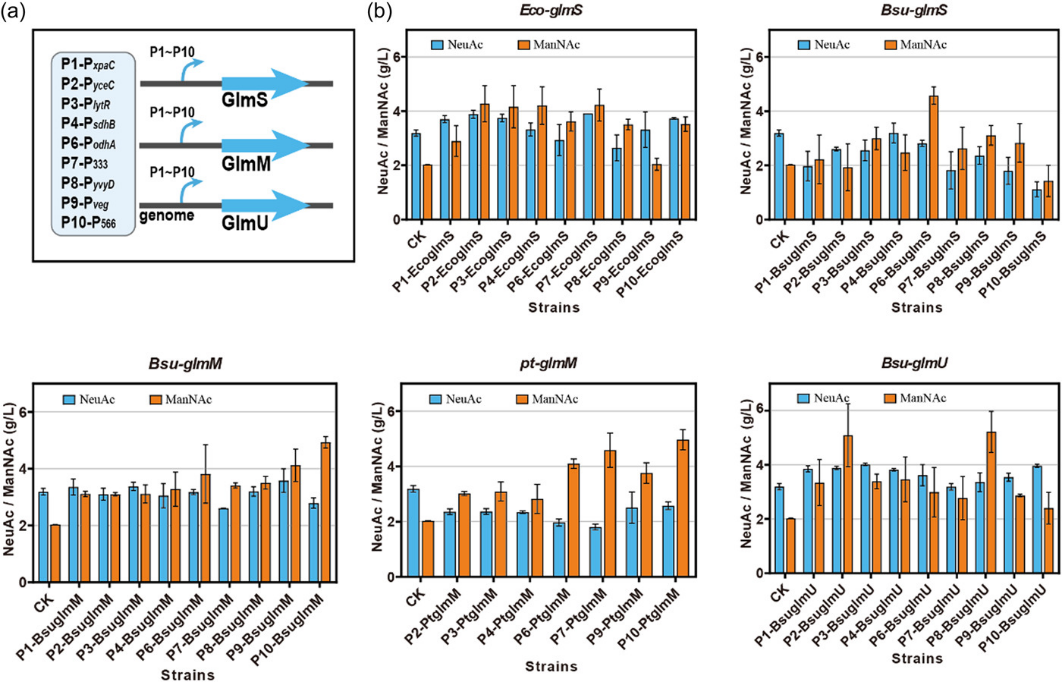
图2 枯草芽孢杆菌中NeuC途径的构建。(a)使用九种不同强度的启动子来优化BsuGlmS、EcoGlmS,BsuGlmU,BsuGlmM和PtGlmM的表达水平;(b)第一轮发酵中NeuAc和ManNAc的效价。
2、优化NeuC途径以提高NeuAc的效价
第一轮优化结束后,基于六个菌株进一步优化了GlmM和GlmU的表达水平。大肠杆菌的GlmS表达水平由五个启动子调控,包括P91、P2、 P3、 P7、 P9,而枯草芽孢杆菌的GlmS由启动子P9调控。发酵结果表明,当大肠杆菌的GlmS被P1启动子调控并且枯草芽孢杆菌的GlmU被P2启动子调控时,NeuAc效价增加至5.20 g/L, 是对照组的1.6倍,而ManNAc积累达到4.20g/L。(图3)
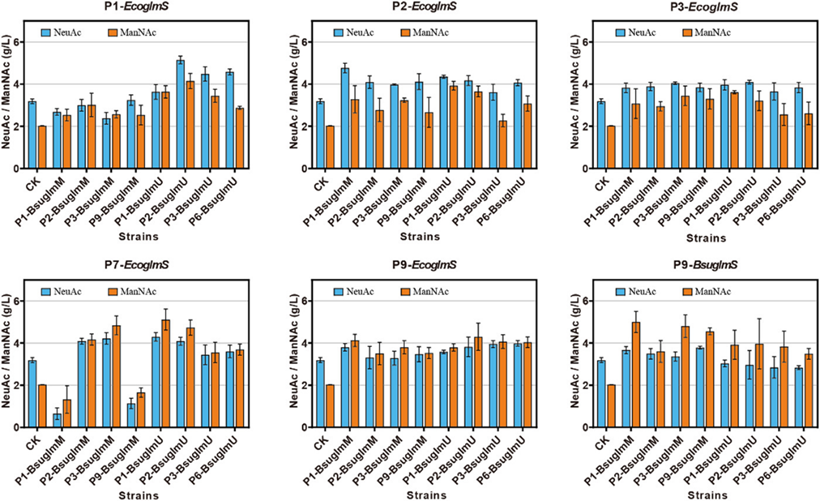
图3 为提高NeuAc效价的NeuC途径优化。使用六株过表达GlmS的菌株,优化了GlmU和GlmM的表达水平。
3、改善NeuB和PEP供应以减少ManNAc的积累
为减少NeuC途径中另一中间产物ManNAc的积累,从定向进化NeuB与增强辅助前体PEP的供应入手,实现了NeuAc产量的提升。加强NeuB的表达可以提高NeuAc合成效率,如共表达来自不同微生物的NeuB。由IPTG诱导的启动子Pgrac调控的EcoNeuB在B8-NemNeuB菌株中过度表达后,发酵结果显示NeuAc的效价可提高1.5倍,从5.2 g/L降至7.6 g/L,而ManNAc的积累从4.1 g/L降至2.7 g/L。(图4a)
此外,增加PEP浓度是改善NeuAc合成的另一潜在途径,本研究通过构建葡萄糖和甘油作为双碳源来增加PEP供应,达到改善NeuAc生产的目的。虽然葡萄糖分解代谢抑制使得甘油不能被用作碳源,但值得注意的是,通过表达甘油激酶(GlpK)可以使葡萄糖分解代谢抑制失活,甘油可作为另一个碳源来增加PEP供应。因此,在启动子P6的控制下,GlpK被过度表达,PEP供应增加。(图4b)葡萄糖和甘油作为双碳源的协同作用对枯草芽孢杆菌的NeuAc合成更为有效,使NeuAc的效价增加到了7.9 g/L, 与此同时,ManNAc的积累减少到2.2 g/L。(图4c)
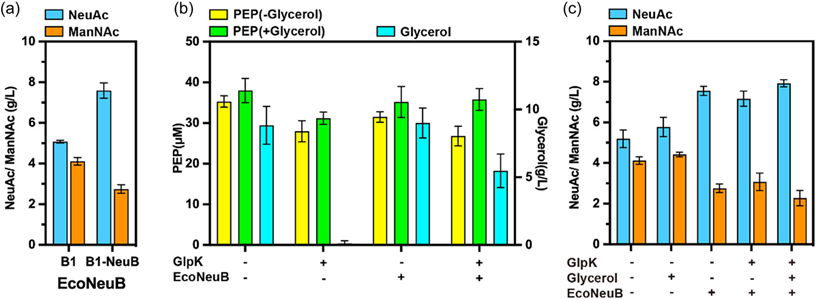
图4 表达EcoNeuB和GlpK以减少ManNAc积累。(a) EcoNeuB表达对NeuAc生物合成的影响。(b) GlpK和EcoNeuB表达对细胞内PEP浓度的影响。(c) GlpK和EcoNeuB对NeuAc效价和ManNAc积累的影响。
4、在3L生物反应器中的NeuAc合成
由于NeuAc生物合成竞争糖酵解和细胞壁合成途径的前体,平衡NeuAc的生物合成和细胞生长对于改善NeuAc合成至关重要。通过在培养基中滴定O-甲基-L-酪氨酸来调节walR基因(编码双分量响应调节器),从而进一步调整细胞生长与NeuAc合成。在3L发酵罐中进行补料分批发酵,NeuAc的效价和生产率分别达到21.8 g/L和0.34 g/L/h。(图5)
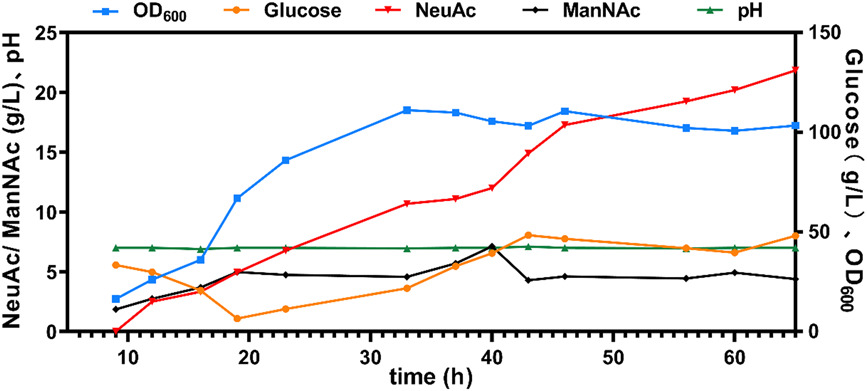
图5 在3L生物反应器中生产NeuAc。基于NeuC途径在3L发酵罐中对B8-glpK菌株进行补料分批发酵。
5、结论
在这项研究中,通过在枯草芽孢杆菌中构建NeuC途径,并优化该途径中关键酶GlmS、GlmM和GlmU的表达水平,在两轮优化之后,得到了高效高产的代谢工程菌株。接着,为了进一步减少中间体ManNAc的积累,我们对编码NeuAc合成酶(NeuB)的NeuB基因进行了定向进化,该基因催化ManNAc向NeuAc的转化。最后,通过过度表达GlpK使葡萄糖分解代谢抑制失活,利用甘油途径来补充NeuAc辅助前体PEP的供应,并在3L发酵罐中进行补料分批发酵以生产NeuAc。
本研究为了消除积累的中间体GlcNAc,首先在枯草芽孢杆菌中重建并优化了不产生GlcNAc的UDP-GlcNAc差向酶途径,从而在消除GlcNAc的情况下使得NeuAc的效价增加了5.9 g/L。然后,为了减少另一种积累的中间体ManNAc,进行了NeuB的定向进化和PEP供应的增强。使用此策略,ManNAc的积累降低了46.3%,NeuAc的效价增加了54.9%,达到7.9 g/L。最后,在3 L发酵罐中NeuAc的最大效价达到21.8 g/L,生产率为0.34 g/L,显著改善了NeuAc的生物生产。
作者及项目简介
本文第一作者是江南大学生物工程学院硕士研究生郭豪玉,通讯作者是江南大学刘延峰研究员。本研究得到国家重点研究发展计划项目(2020YFA0908300)、国家优秀青年科学基金项目(32222069)、国家自然科学基金创新课群基金项目(32021005)、国家自然科学基金项目(32172349)、江苏省自然科学基金项目(BK20200085)、江苏省重点研究发展计划项目(BE2019628)资助。
