近日,Bioresource Technology在线发表了江南大学糖化学与生物技术教育部重点实验室刘龙教授课题组的研究成果“Modular remodeling of sterol metabolism for overproduction of 7-dehydrocholesterol in engineered yeast” (Xiu et al., Bioresource Technology, 2022: 127572)。江南大学2019级博士生修翔为论文第一作者,刘龙教授为论文通讯作者。
维生素D3是人体必需的脂溶性维生素,在人体生长、发育和维持健康方面发挥重要作用。维生素D3可以作为保健药物、膳食补充剂和营养强化剂,拥有巨大的市场。作为合成维生素D3的重要前体,7-脱氢胆固醇(7-Dehydrocholesterol,7-DHC)的合成受到广泛关注。目前工业生产7-DHC主要采用化学合成法,以羊毛脂为原料,经酯化、氧化、还原和水解等多步反应合成。在整个合成过程中,需要严苛的反应条件并加入大量有机试剂,不仅会对环境造成污染,而且伴随着各种副产物的生成。相比而言,微生物合成法因其副产物少、环保、可持续等特点而更具吸引力。目前虽有利用酵母合成7-DHC的报道,但由于7-DHC合成路径较长,采用传统的基因敲除和过表达策略难以实现7-DHC的高效合成。
针对以上问题,该研究选择酿酒酵母(Saccharomyces cerevisiae)作为出发菌株,通过重构甾醇代谢模块最终实现了7-DHC的高效合成。首先,将7-DHC合成路径分为4个模块:中心代谢模块、甲羟戊酸模块、角鲨烯模块和7-DHC模块。使用PGAL启动子过表达四个模块中的6个基因(tHMG1、IDI1、ERG1、ERG11、ADH2和ERG7),并选择PTEF1启动子过表达调控甾醇代谢的转录因子突变体UPC2G888A,菌株7-DHC产量从1.2 mg/L增加到115.3 mg/L(图1)。其次,构建了CRISPR/dCpf1介导的转录激活系统和CRISPR/dCas9介导的转录抑制系统,前者进一步激活使用PGAL启动子驱动的关键基因的表达(图2),后者抑制7-DHC合成过程中分支路径的关键基因(ERG6、MLS1和CIT2)的表达,菌株7-DHC的产量提升至312.4 mg/L(图3)。
参与合成7-DHC的酶分布于不同的亚细胞结构中,这可能不利于中间代谢物的传递,进而影响7-DHC的合成。为了避免上述问题,该研究将角鲨烯和7-DHC模块中的6个基因(ERG7、ERG20、IDI1、MVD1、ERG8和ERG12)依次重定位于内质网中,通过内质网区室化进一步重构甾醇代谢路径。在此基础上,过表达INO2增加内质网表面积(图4),摇瓶发酵结果显示,7-DHC的产量显著增加,达到455.6 mg/L。在5 L发酵罐上,通过补料分批发酵,获得2870 mg/L的7-DHC,是迄今为止报道的最高产量(图5)。
上述研究工作得到了国家重点研发项目(2018YFA0900300)、国家自然科学基金(31930085, 32021005)、中央高校基本科研专项资金(JUSRP121010, JUSRP221013, JUSRP52019A)等项目的资助。
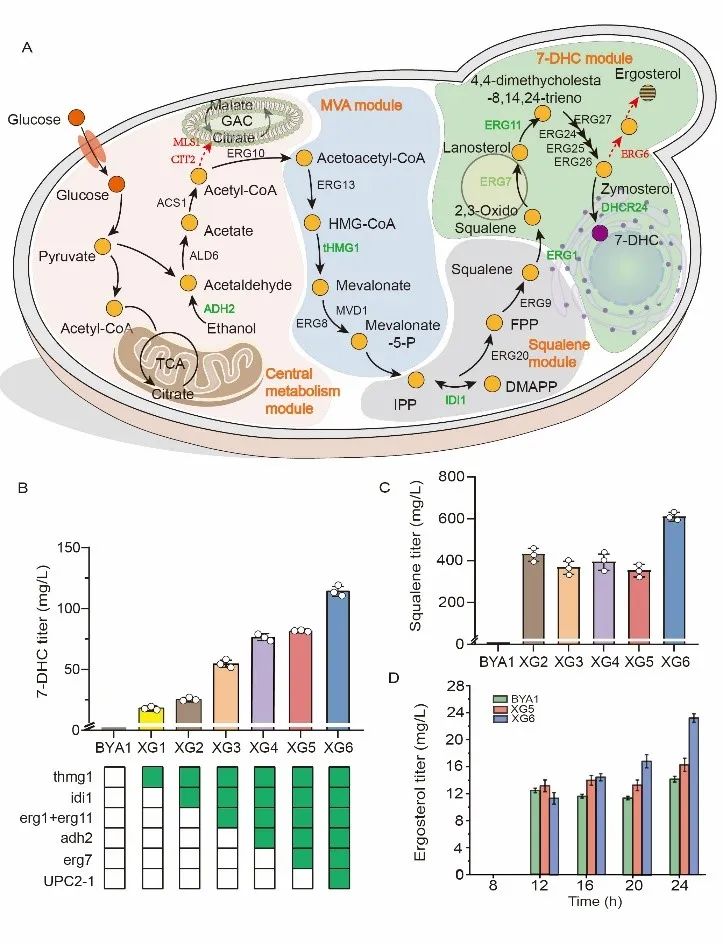
图1 模块化改造酿酒酵母提升7-DHC产量
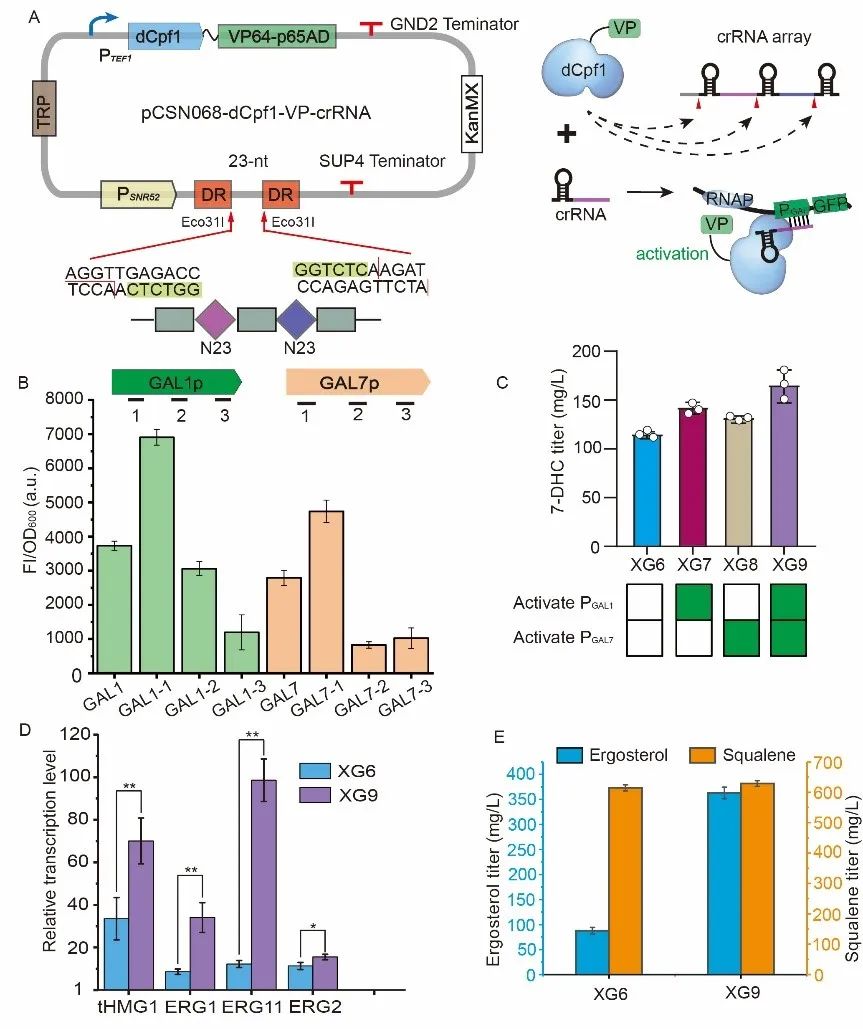
图2 CRISPR/dCpf1激活系统的构建与应用

图3 CRISPR/dCas9抑制系统的构建与应用
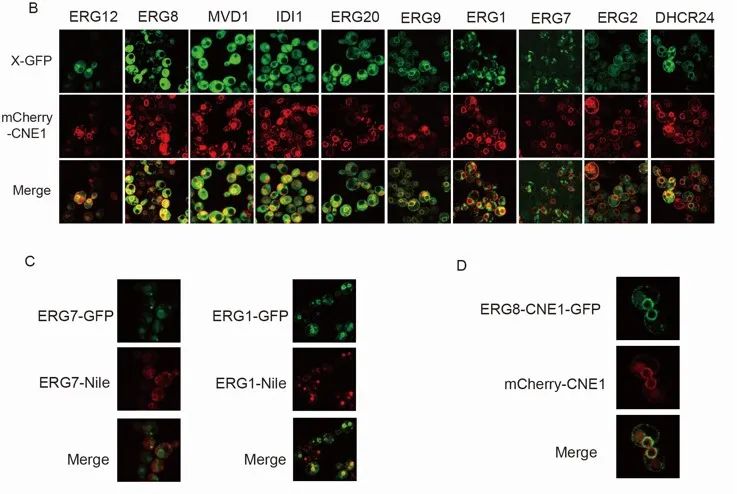
图4 甾醇代谢路径的重构
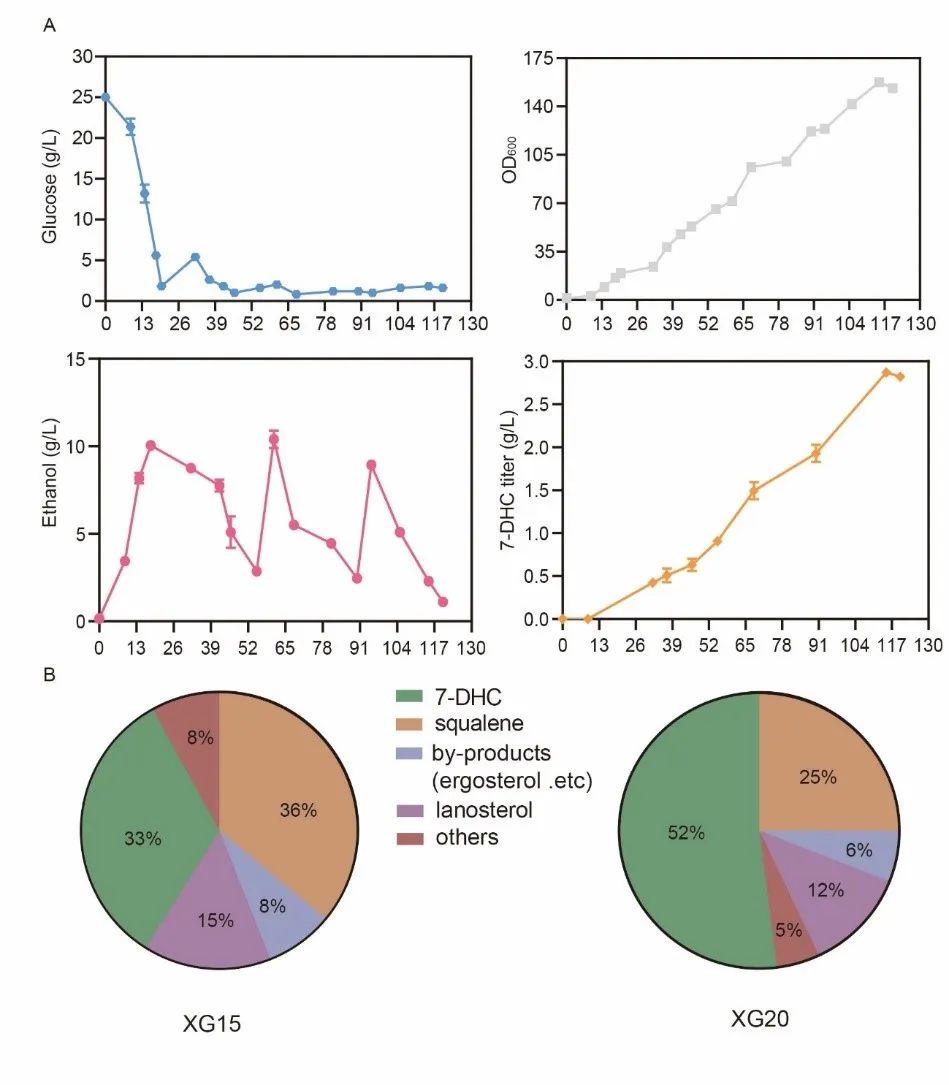
图5 5 L发酵罐中补料分批发酵
