近日,Nature Communications在线发表了江南大学糖化学与生物技术教育部重点实验室刘龙教授课题组的研究成果“De novo biosynthesis of rubusoside and rebaudiosides in engineered yeasts”(Xu et al., Nature Communications. 2022. 13:3040) (https://www.nature.com/articles/s41467-022-30826-2)。刘龙教授为论文的通讯作者,我院2018级博士生徐雅梦为论文第一作者。
随着高糖、高热量饮食引发的糖尿病、高血压、肥胖等一系列健康问题被广泛关注,具有高甜度、低热值等特点的甜味剂的开发已成为近年来的研究热点。其中,植物来源的天然低热甜味剂(如甜茶苷、莱鲍迪苷等)因具有安全、稳定等优点备受消费者的青睐,目前已被广泛应用于食品和饮品等行业。
甜菊糖苷是从甜叶菊中提取的一类天然甜味剂,根据其侧链上葡萄糖基位置和个数的不同,可分为甜茶苷、甜菊苷、莱鲍迪苷A、莱鲍迪苷B、莱鲍迪苷C等60余种类型。目前市场上的甜菊糖苷主要来源于植物提取。但植物中甜菊糖苷的丰度低,植物生长具有季节依赖性,且提取过程复杂,这限制了甜菊糖苷的大规模生产。与传统的植物提取法相比,微生物发酵法能够克服以上缺点,有效地提高甜菊糖苷的合成效率。因此,通过构建微生物底盘细胞,以廉价碳源为底物从头合成甜菊糖苷具有重要意义。
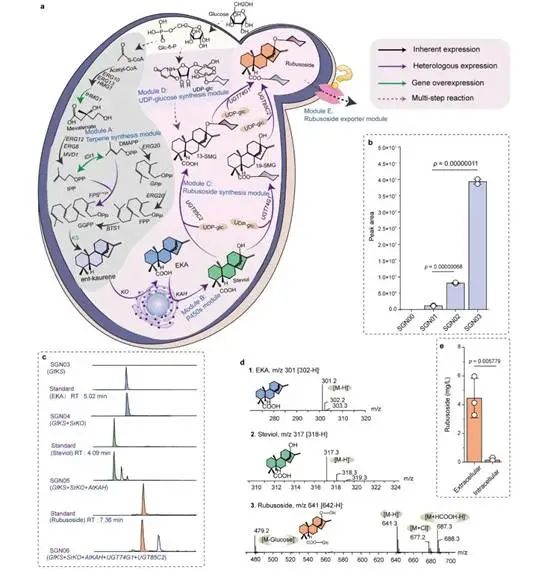
甜茶苷从头合成底盘细胞的构建
为此,本研究在酿酒酵母中重构甜茶苷代谢合成途径。首先,基于合成生物学中的代谢网络模块化方法将甜茶苷合成途径分为5个模块,包括萜类合成模块、P450s模块、甜茶苷合成模块、UDP-葡萄糖合成模块和甜茶苷转运模块。通过优化萜类合成模块,并引入P450s模块和甜茶苷合成模块,成功获得甜茶苷产量为4.5 mg/L的生产底盘(图1)。其次,通过改造P450酶、构建人工底物代谢通道、扩大内质网等策略解除P450s模块中的限速步骤,甜茶苷产量提高至67.7 mg/L(图2)。随后,结合蛋白质结构预测、分子对接等技术开发了一种针对甜茶苷转运模块外排泵筛选的快捷方法。通过外排泵抑制实验判定甜茶苷外排泵属于ABC外排泵家族;经实验验证PDR11为酿酒酵母中甜茶苷的外排泵;强化甜茶苷转运模块后,产量提高至155.6 mg/L;同时,本研究通过强化MSN4表达提高工程菌株对甜茶苷的适应性后,甜茶苷的产量达到205.5 mg/L(图3)。最后,针对甜茶苷合成途径构建了基因组规模代谢网络模型,并应用OptKnock算法预测甜茶苷生产底盘中的基因敲除靶点,发现UDP-葡萄糖供给不足是限制甜茶苷高效合成的一个关键因素,通过UDP-葡萄糖合成模块进行优化与代谢流再分配后,甜茶苷在摇瓶中的产量达到302.1 mg/L,经15-L发酵罐放大培养后,甜茶苷产量达到1368.6 mg/L(图4)。
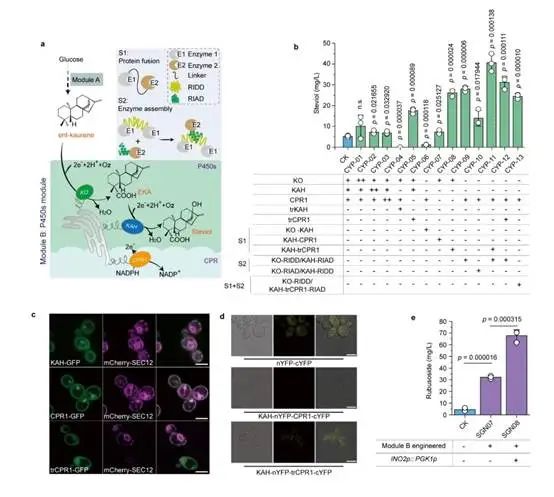
P450s模块关键限速步骤的分析与解除
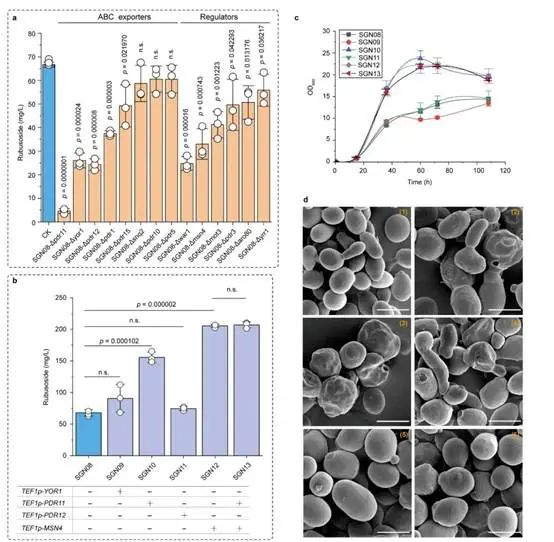
甜茶苷外排转运体的挖掘与调控
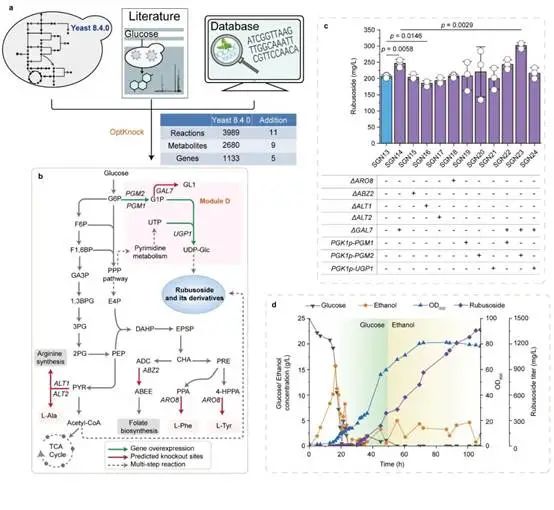
基于基因组规模代谢网络模型的
代谢瓶颈预测与调控
为了进一步验证上述底盘细胞的普适性,本研究基于甜茶苷生产底盘,引入莱鲍迪苷合成途径,成功实现莱鲍迪苷的从头合成。随后,基于Rosette软件对关键限速酶EUGT11进行半理性设计,并通过表达元件改造与动态调控进行代谢流的优化,莱鲍迪苷(RA、RD、RM)在15-L发酵罐中产量达到132.7 mg/L(图5)。总之,本研究通过系统代谢工程策略构建了一株高产甜茶苷和莱鲍迪苷的生产底盘细胞,所采用的研究策略对于其他天然产物合成底盘细胞的构建具有借鉴意义。上述研究得到了国家重点研发项目(2020YFA0908300)、国家自然科学基金(32021005、31930085、31870069)等项目的资助。
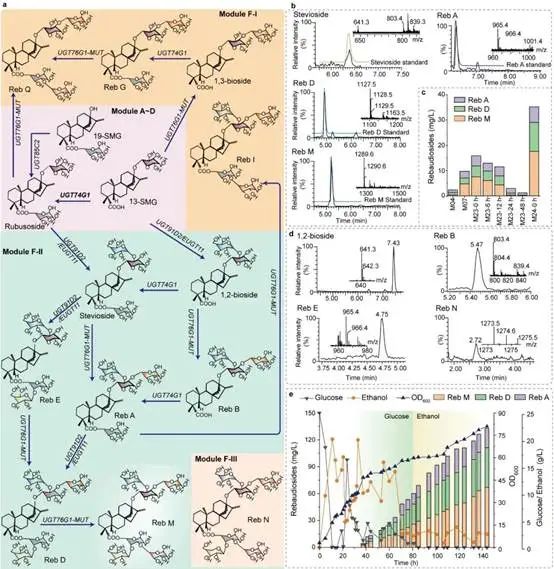
莱鲍迪苷生产底盘细胞的构建与优化
