近期,江南大学糖化学与生物技术教育部重点实验室吴志猛教授团队在双特异性抗体药物开发方面取得新进展,研究成果
“Chemoenzymatic Synthesis of a Rhamnose-Functionalized Bispecific Nanobody as a Bispecific Antibody Mimic for Cancer Immunotherap”在国际化学顶级期刊Angew. Chem. Int. Ed.上发表(https://onlinelibrary.wiley.com/doi/10.1002/anie.202208773)。
双特异性抗体(bsAbs)是下一代抗体类生物药。其中,Non-IgG-like双特异性抗体是抗体片段组成的新型bsAbs,具有结构简单、易于生产和肿瘤组织渗透性高等特点。然而Non-IgG-like双特异性抗体不含有全长抗体的Fc端,因此无法发挥Fc介导的免疫效应功能,如抗体依赖细胞介导的细胞毒作用(ADCC)、抗体依赖细胞介导的细胞吞噬作用(ADCP)和补体依赖的细胞毒作用(CDC);另外,该类新型双特异性抗体由于分子量小,在体内的半衰期短,需要频繁给药才能达到治疗效果。
吴志猛教授研究团队在前期研究基础上,提出一种新策略--设计和合成了一种鼠李糖(Rha)修饰的双特异性纳米抗体(bsNb),提出将人体血清中存在的天然抗Rha抗体募集至肿瘤细胞表面,或与抗Rha抗体形成免疫复合物,分别达到激活Fc介导的免疫杀伤和延长半衰期的目的(图1)。团队设计和合成了不同长度PEG连接臂的bsNb-Rha偶联物,通过体外活性评价,发现PEG2的偶联物R2表现出最强的免疫治疗效果,且其效果也由于相应的单特异性纳米抗体(msNb)-Rha偶联物7D12-Rha和C7b-Rha(图2)。此外,该团队在小鼠体内证实R2具备显著的半衰期延长效应;在荷瘤小鼠中则发现,R2的肿瘤抑制率明显未Rha修饰的bsNb 7D12-C7b、以及两种msNb-Rha偶联物(图3)。该工作为开发新型基于抗体片段的bsAb药物提供了新思路。
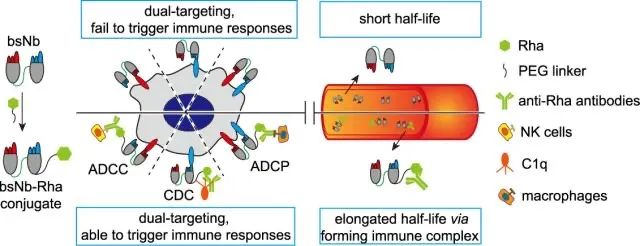
图1研究概览
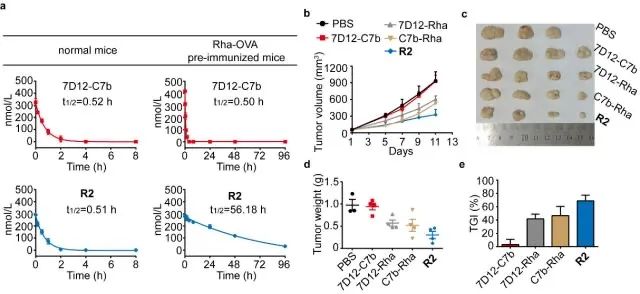
图2 bsNb-Rha偶联物的ADCC、ADCP和CDC活性评估
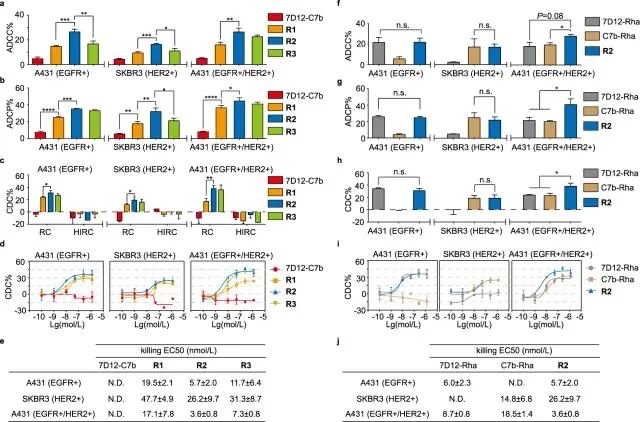
图3 bsNb-Rha偶联物的药代动力学和体内抗肿瘤活性评估
募集内源性抗体用于肿瘤相关疾病的治疗是一种肿瘤免疫治疗新策略。与传统抗体类生物药介导的被动免疫治疗相比,内源抗体募集策略具有独特优势,主要表现在:(1)半抗原小分子的化学可设计性;(2)抗体募集分子引起的免疫副反应风险低。糖化学与生物技术教育部重点实验室吴志猛教授研究团队近年来提出募集内源性抗体用于重构或增强生物大分子的免疫效应功能,并取得一系列研究进展(J Med Chem, 2022, 65: 323-332;Chem Commun., 2022,58, 2568-2571;Chem Sci, 2021, 12: 4623-4630;Eur J Pharm Sci, 2021, 165: 105941; ChemMedChem,2021,16,2907-2968;Chem Commun., 2020,56, 13959-13962;Chem Sci, 2019, 10: 9331-9338)。
江南大学糖化学与生物技术教育部重点实验室洪皓飞博士为该论文的第一作者,吴志猛教授为该论文通讯作者。研究团队特别感谢中国科学院上海药物研究所黄蔚研究员、原江南大学高晓冬教授和藤田盛久教授对本工作提供的帮助。以及国家自然科学基金、生物工程学院青年人才托举工程等项目对本工作提供的资助。
